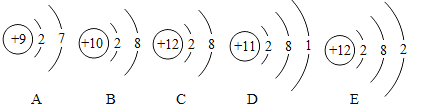题目内容
【题目】归纳总结是学习化学的重要方法,某化学兴趣小组学习碱的性质后,通过实验对氢氧化钙的化学性质进行了验证和总结,如图所示“——”表示物质两两之间能发生化学反应。请根据如图,回答问题。(已知:CaCl2溶液呈中性)

(1)甲同学将酚酞试液滴入氢氧化钙溶液中,观察到溶液变红,得出结论:氢氧化钙溶液呈______(填“酸性”、“碱性”或“中性”);
(2)乙同学将过量的稀盐酸加入到甲同学所得溶液中,观察到的现象是______,此时所得溶液中含有的溶质有______(酸碱指示剂除外);
(3)丙同学将碳酸钠溶液加入氢氧化钙溶液中,充分反应后,与乙同学所得溶液混合,静置后发现:上层为无色透明的溶液,底部有白色沉淀。则上层溶液中一定含有的溶质是______(酸碱指示剂除外);该反应的化学方程式为:____________。
【答案】碱性 红色变浅至完全消失 氯化钙、氯化氢(CaCl2、HCl) 氢氧化钠 Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
【解析】
(1)酚酞溶液遇酸性溶液不变色,遇碱性溶液变红色,甲同学将酚酞试液滴入氢氧化钙溶液中,观察到溶液变红,说明氢氧化钙溶液呈碱性。
(2)乙同学将过量的稀盐酸加入到甲同学所得溶液中,稀盐酸与氢氧化钙反应生成氯化钙和水,由于稀盐酸过量,最终溶液显酸性,观察到的现象是溶液红色褪去;此时所得溶液中含有的溶质有氯化钙(CaCl2)、氯化氢(HCl)。
(3)丙同学将碳酸钠溶液加入氢氧化钙溶液中,碳酸钠与氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,则上层溶液中一定含有的溶质是氢氧化钠;该反应的化学方程式为:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH。

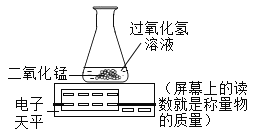
【题目】某兴趣小组同学对实验室“过氧化氢分解制氧气”的条件进行了如下探究。
[探究活动1]探究催化剂的种类对过氧化氢分解速率的影响。
设计实验:小组同学设计下列对比实验,实验①:将30g10%过氧化氢溶液与1g二氧化锰均匀混合:实验②将xg 10%过氧化氢溶液与1g氧化铜均匀混合。
实验①中反应的化学方程式是_____;实验②中x的值应为_____。
[探究活动2]探究一些因素对过氧化氢分解速率的影响。
收集证据:小组同学通过实验采集到相关实验数据如下表。
过氧化氢溶液的质量 | 过氧化氢溶液的浓度 | 二氧化锰的质量 | 相同时间内产生氧气体积 | |
Ⅰ | 50. 0g | 1% | 0.1g | 9mL |
Ⅱ | 50. 0g | 2% | 0.1g | 16mL |
Ⅲ | 50. 0g | 4% | 0.1g | 31mL |
问题与讨论: (1) 本实验的结论是_____。
(2)实验时,测量氧气体积的装置应选择下图中_____(填编号)。
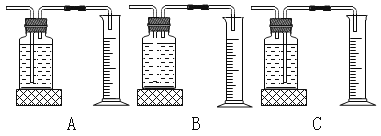
(3)小强同学设计了下图所示装置完成上述实验,通过比较相同时间内_____同样能获取该实验的结论。