题目内容
【题目】盐酸、硫酸、氢氧化钠是重要的化工原料。
(1)浓硫酸是实验室常用的气体干燥剂,说明浓硫酸具有________性。
(2)稀盐酸和稀硫酸都可以用于金属除锈,是因为他们的溶液中都含有________(填符号)。
(3)实验室有一瓶久置的氢氧化钠固体,为探究其是否变质,同学们进行了如下实验:
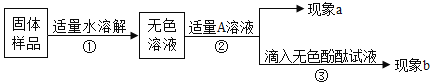
①氢氧化钠变质的原因是___________________(用化学方程式表示);
②若现象a为有气泡产生,则加入的A溶液可能是__________,说明氢氧化钠已经变质,写出产生气泡的反应的化学方程式_______________。
③进一步探究固体变质的程度,若加入的A是过量的CaCl2溶液(CaCl2溶液呈中性),现象a为__________,现象b为_________,则证明该氢氧化钠固体部分变质,写出发生反应的化学方程式_________。
【答案】吸水 H+ ![]() 稀盐酸或稀硫酸
稀盐酸或稀硫酸 ![]() 白色沉淀 无色酚酞试液变红
白色沉淀 无色酚酞试液变红 ![]()
【解析】
(1)浓硫酸是实验室常用的气体干燥剂,说明浓硫酸具有吸水性。
(2)稀盐酸和稀硫酸都可以用于金属除锈反应产生盐和水,是因为他们的溶液中都含有氢离子(H+);
(3)①氢氧化钠变质的原因是与空气中的二氧化碳反应产生碳酸钠和水:![]() ;
;
②若现象a为有气泡产生,则加入的A溶液可能是稀盐酸(或稀硫酸)说明氢氧化钠已经变质,碳酸钠与稀盐酸(或稀硫酸)反应产生氯化钠(或硫酸钠)、水和二氧化碳气体,的化学方程式:![]() 或
或![]()
③进一步探究固体变质的程度,若加入的A是过量的CaCl2溶液,氯化钙与碳酸钠反应产碳酸钙沉淀和氯化钠,现象a为:产生白色沉淀,溶液中依然有未变质的氢氧化钠显碱性,现象b为无色酚酞试液与碱变红,则证明该氢氧化钠固体部分变质,氯化钙与碳酸钠反应产碳酸钙沉淀和氯化钠的化学方程式:![]() 。
。