题目内容
【题目】把氯酸钾和二氧化锰的混合物31g放入大试管中加热,充分反应后冷却、称量,剩余固体质量为21.4g。问:
(1)制得氧气多少克_______?
(2)剩余固体里有哪些物质______?各多少克______?
【答案】9.6g 氯化钾、二氧化锰 14.9g、6.5g
【解析】
据质量守恒定律可知,过程中质量的减少是因为生成了氧气,所以可以求算氧气的质量,根据氧气的质量和对应的化学方程式求算生成的氯化钾的质量,进而求算二氧化锰的质量。
解:(1)根据质量守恒定律可得,生成的氧气的质量为31g-21.4g=9.6g;
(2)由于是充分反应,所以剩余物质为生成的氯化钾和作催化剂的二氧化锰;设生成的氯化钾的质量为x,
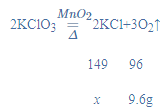
![]()
x=14.9g,
则二氧化锰的质量为21.4g-14.9g=6.5g,
答:(1)制得氧气为9.6g;(2)剩余固体里有氯化钾和二氧化锰,质量分别为14.9g和6.5g。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
【题目】黄铜是一种重要的金属,它是铜和锌的合金,可用来制造机器、电器零件及日常用品。为了测定黄铜样品的组成,取五份样品分别加稀硫酸反应,其实验数据记录如下:
样品 | 第1份 | 第2份 | 第3份 | 第4份 | 第5份 |
取样品质量(g) | 40.0 | 40.0 | 40.0 | 40.0 | 40.0 |
取稀硫酸质量(g) | 30.0 | 60.0 | 90.0 | 120.0 | 150.0 |
产生气体质量(g) | 0.3 | 0.6 | 0.9 | 1.0 | 1.0 |
按要求回答下列问题:
(1)根据实验数据分析,从第___份开始,金属已经反应完全了。
(2)列式计算该黄铜样品中金属锌的质量分数___。(要求写出计算过程)
(3)在给出的坐标纸上,画出40.0g样品中加稀硫酸的质量与产生气体质量的关系曲线___。