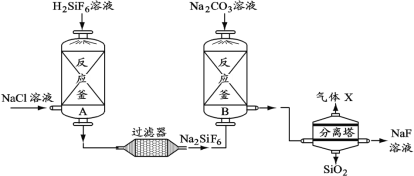
题目内容
【题目】实验兴趣小组对制取二氧化碳实验中剩余的滤液产生了浓厚的兴趣,已知在实验过程中加入的稀盐酸过量,溶质只含有氯化钙和氯化氢两种物质,为了探究各成分的质量进行了如下的实验。请回答下列问题:
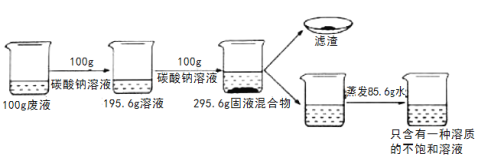
(1)写出生成沉淀的化学反应方程式 ____________
(2)写出求解溶液中氯化氢质量的比例式________________
(3)滤渣的质量为_____________
(4)第一次加入碳酸钠溶液的质量至80 g时溶液中溶质的成分___(填化学式);
(5)最终所得不饱和溶液中溶质的质量分数为_________
【答案】Na2CO3 +CaCl2 ═CaCO3↓+2NaCl ![]() 10g NaCl、HCl、CaCl2 11.7%
10g NaCl、HCl、CaCl2 11.7%
【解析】
碳酸钠与盐酸反应生成气体,碳酸钠与氯化钙反应生成碳酸钙沉淀。
氯化钙和碳酸钠反应生成碳酸钙沉淀和氯化钠,化学方程式为:
Na2CO3 +CaCl2 ═CaCO3↓+2NaCl;
(2)设溶液中氯化氢质量为x,反应生成氯化钠质量为y,参加反应的碳酸钠的质量为z
反应生成二氧化碳质量为:100g+100g-195.6g=4.4g,

![]()
解得:x=7.3g,y=11.7g,z=10.6g
故求解溶液中氯化氢质量的比例式为:![]()
(3)第一次加入碳酸钠溶液没有沉淀生成并且溶液反应后总量减少,说明滤液中
含有盐酸,第二次加入碳酸钠溶液有固体生成说明碳酸钠与氯化钙反应生成了碳酸
钙沉淀
设生成碳酸钙的质量为a,生成氯化钠的质量为b
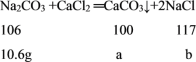
![]()
解得:a=10g , b=11.7g
所以滤渣的质量为10g;
(4)加入100g的碳酸钠溶液,恰好完全反应,所以第一次加入碳酸钠溶液的质量
至80g时,盐酸有剩余,溶液中溶质的成分是NaCl、HCl、CaCl2 ;
(5)最终所得不饱和溶液中溶质的质量分数为![]() =11.7%
=11.7%

【题目】黄铜是一种重要的金属,它是铜和锌的合金,可用来制造机器、电器零件及日常用品。为了测定黄铜样品的组成,取五份样品分别加稀硫酸反应,其实验数据记录如下:
样品 | 第1份 | 第2份 | 第3份 | 第4份 | 第5份 |
取样品质量(g) | 40.0 | 40.0 | 40.0 | 40.0 | 40.0 |
取稀硫酸质量(g) | 30.0 | 60.0 | 90.0 | 120.0 | 150.0 |
产生气体质量(g) | 0.3 | 0.6 | 0.9 | 1.0 | 1.0 |
按要求回答下列问题:
(1)根据实验数据分析,从第___份开始,金属已经反应完全了。
(2)列式计算该黄铜样品中金属锌的质量分数___。(要求写出计算过程)
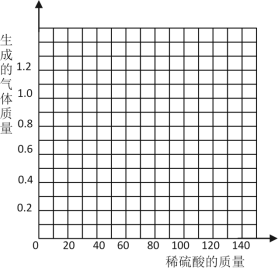
(3)在给出的坐标纸上,画出40.0g样品中加稀硫酸的质量与产生气体质量的关系曲线___。