题目内容
【题目】50g Ca(NO3)2溶液与50g K2CO3溶液混合后,二者恰好完全反应.经过滤、干燥、称量,得到5g沉淀.反应的化学方程式是:K2CO3+Ca(NO3)2═CaCO3↓+2KNO3.
请计算:
(1)参加反应的K2CO3的质量.
(2)过滤后所得溶液的溶质质量分数.
【答案】6.9g;10.6%.
【解析】
根据Ca(NO3)2与50g K2CO3反应的化学方程式和生成沉淀的质量,列出比例式,就可计算出参与反应的K2CO3的质量和生成KNO3的质量,然后根据溶质质量分数=![]() 计算即可。
计算即可。
设:参与反应的K2CO3的质量为x,生成KNO3的质量为y,
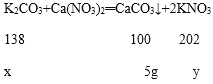
![]() 解得:x=6.9g;
解得:x=6.9g;
![]() 解得:y=10.1g;
解得:y=10.1g;
溶液的质量=50g+50g﹣5g=95g,
所得溶液的溶质质量分数为:![]() ≈10.6%。
≈10.6%。
答:(1)参加反应的K2CO3的质量为6.9g;
(2)过滤后所得溶液的溶质质量分数为10.6%。

练习册系列答案
相关题目