题目内容
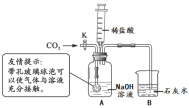
【题目】硫酸锌是木材保存剂的主要成分。某工厂产生的废渣(主要成分为ZnO,少量Fe2O3、CuO)可用于制备ZnSO4,其工艺流程如图所示。
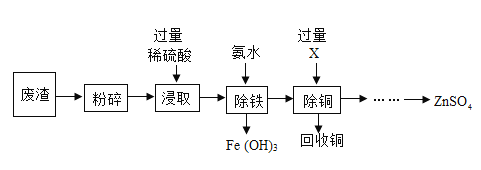
(1)“粉碎”的目的是_____。
(2)“浸取”所得溶液的金属阳离子有Zn2+、Cu2+和_____(填离子符号)。
(3)“除铁”步骤中加入氨水后的操作是____,在实验室该操作必须用到的玻璃仪器是漏斗、烧杯和___。
(4)“除铜”时发生反应的化学方程式是___。
(5)将90 g废渣进行以上流程实验,最终得到6.4 g铜和161 g的ZnSO4,假设废渣中金属元素没有损失,则该废渣中ZnO的质量分数是_____。
【答案】增大反应物接触面积,加快反应速率 Fe3+ 过滤 玻璃棒 Zn+CuSO4═ZnSO4+Cu 81%
【解析】
(1)物质之间反应时,接触面积越大,反应越充分越快,所以粉碎的目的是 使反应物接触更充分更快;
(2)加入过量的硫酸之后,氧化铜能与硫酸反应生成硫酸铜,氧化锌能与硫酸反应生成硫酸锌,氧化铁能与硫酸反应生成硫酸铁,故“浸取”所得溶液的金属阳离子有Zn2+、Cu2+和Fe3+;
(3))“除铁”步骤中加入氨水后是分离沉淀和溶液,操作步骤是:过滤,在实验室该操作必须用到的玻璃仪器是漏斗、烧杯和玻璃棒(用于引流)。
(4)由于锌是过量的,所以过滤得到的滤渣中含有金属单质有剩余的锌和生成的铜,除铜时发生的反应方程式为Zn+CuSO4═ZnSO4+Cu 。
(5)设,得到6.4 g铜时,生成硫酸锌的质量为x
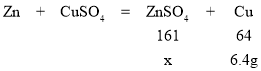
![]()
x=16.1g
设废渣中ZnO的质量为y,
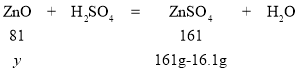
![]()
y=72.9g
该废渣中ZnO的质量分数是=![]() ;
;

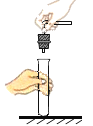
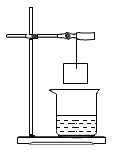
【题目】小华将一张滤纸在某指示剂 X 中浸泡后晾干,用蘸有氢氧化钠溶液的玻璃棒在上面写“化学”两字,立刻显红色。再将其悬挂于铁架台上,并在滤纸的下方(如图)放置一个盛有某溶液 Y 的烧杯,过一会儿,发现红色的字消失,则滤纸上的指示剂 X 和烧杯中的溶液 Y 分别是( )
A | B | C | D | |
指示剂 X | 酚酞溶液 | 酚酞溶液 | 石蕊溶液 | 石蕊溶液 |
溶液 Y | 浓氨水 | 浓盐酸 | 浓氨水 | 浓盐酸 |
A.AB.BC.CD.D