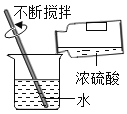
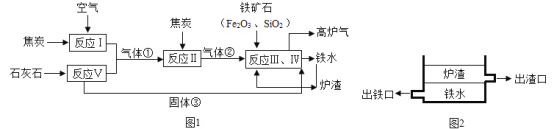
题目内容
【题目】实验小组用传感器研究稀盐酸和稀NaOH溶液的反应。实验过程中温度和pH变化趋势如下图所示。
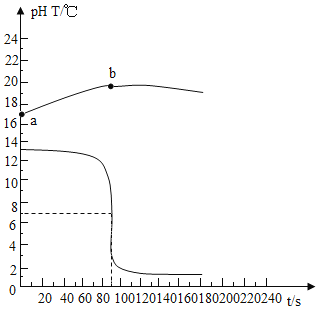
(1)上述反应的化学方程式是______。
(2)曲线a ~ b上升的原因是______。
(3)下列说法正确的是______(填序号)。
A 该实验是将稀盐酸滴入稀NaOH溶液中
B 60 s时对应溶液中的溶质是NaCl
C 120 s时向溶液中加入酚酞,溶液不变色
D 180 s时向溶液中加入Na2CO3溶液,能证明稀盐酸和稀NaOH溶液发生反应
【答案】![]() 氢氧化钠和稀盐酸反应放热 AC
氢氧化钠和稀盐酸反应放热 AC
【解析】
稀盐酸和氢氧化钠反应生成氯化钠和水。
(1)稀盐酸和氢氧化钠反应生成氯化钠和水,反应的化学方程式是![]() 。
。
(2)由图可知,a ~ b所在的曲线是温度变化曲线,氢氧化钠和稀盐酸反应放热,a ~ b段温度升高,故曲线a ~ b上升的原因是氢氧化钠和稀盐酸反应放热。
(3)A、开始溶液的pH大于7,溶液显碱性,最终溶液的pH小于7,溶液显酸性,则该实验是将稀盐酸滴入稀NaOH溶液中,故A正确;
B、60 s时,pH>7,溶液显碱性,说明氢氧化钠未完全反应,氢氧化钠与稀盐酸反应生成氯化钠和水,故对应溶液中的溶质是氢氧化钠、氯化钠,故B不正确;
C、120 s时,溶液显酸性,酸不能使酚酞溶液变色,则向溶液中加入酚酞,溶液不变色,故C正确;
D、180 s时溶液中的稀盐酸过量,稀盐酸和碳酸钠反应,生成二氧化碳气体,有气泡产生,氢氧化钠与碳酸钠不反应,无法验证氢氧化钠是否存在,不能证明氢氧化钠与稀盐酸发生了反应,故D不正确。故选AC。

 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案【题目】工业上冶炼金属锌主要有火法和湿法两种工艺。
(1)火法炼锌时发生如下反应:
2ZnS+3O2 2ZnO+2SO2;2C+O2
2ZnO+2SO2;2C+O2 2CO;ZnO+CO
2CO;ZnO+CO Zn+CO2。
Zn+CO2。
①化合物ZnS中Zn元素的化合价是_____,上述反应在鼓风炉中控制温度在1100℃至1300℃进行,使生成的锌气化蒸馏出来,蒸馏过程属于_____变化。
②已知反应前矿石中ZnS的质量为ag,则理论上可以生成Zn的质量为_____g(用含a的式子表示,可不化简)。
(2)湿法炼锌的原理是利用CO32-与Zn2+结合生成ZnCO3沉淀。某研究小组利用该原理,用碳酸钠作为沉淀剂,探究从含锌废水中回收锌的最佳条件,实验的数据如下:
实验编号 | 初步处理的废液用量/mL | pH值 | 反应时间/min | 沉锌率% |
a | 800 | 6 | 30 | 84.30 |
b | 800 | 7.5 | 10 | 85.27 |
c | 800 | 7.5 | 30 | 99.60 |
d | 800 | 8.0 | 30 | 99.55 |
①本实验探究了哪些因素对沉锌率的影响_____。
②已知碳酸钠溶液呈碱性。实验中碳酸钠使用量最大的是_____(填编号)。工业生产中采用实验_____(填编号)的提取条件更合理。