题目内容
【题目】氯化钙在生活中常用作干燥剂、融雪剂,在工业上可用于制造防冻液等。某工厂以石灰石(原料石灰石中含的杂质是MgSO4和Al2O3为原料生产氯化钙晶体的流程如图(所加试剂均完全反应)。
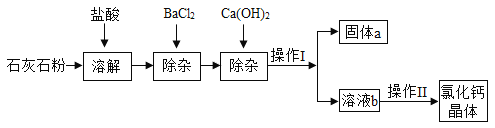
(1)石灰石粉加适量盐酸溶解时,Al2O3发生反应的化学方程式为_____。
(2)加入适量的Ca(OH)2溶液是为了除去_____(填离子符号)。
(3)加入适量的BaCl2溶液发生反应的化学方程式为_____。
(4)操作Ⅰ、操作Ⅱ中玻璃棒的作用_____(选填“相同”或“不同”)。
【答案】Al2O3+6HCl=2AlCl3+3H2O Mg2+、Al3+ MgSO4+BaCl2=BaSO4↓+MgCl2 不同
【解析】
(1)氧化铝与盐酸反应生成氯化铝和水,化学方程式为Al2O3+6HCl=2AlCl3+3H2O。
(2)铝离子与氢氧根离子可以生成氢氧化铝,镁离子与氢氧根离子可以生成氢氧化镁,两者都不溶于水,故除去Mg2+、Al3+
(3)氯化钡与硫酸镁反应生成氯化镁和硫酸钡沉淀,化学方程式为MgSO4+BaCl2=BaSO4↓+MgCl2。
(4)操作Ⅰ为过滤,玻璃棒主要是引流,操作Ⅱ为蒸发结晶,玻璃棒主要是搅拌,所以玻璃棒的作用不同。

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案【题目】现有一包黑色固体粉末,可能含有炭粉、氧化铜、四氧化三铁中的两种或者三种,某化学兴趣小组通过实验探究其成分。
(提出问题):该黑色固体粉末成分是什么?
(作出猜想):
猜想一:混合固体是炭粉、氧化铜 猜想二:混合固体是炭粉、四氧化三铁
猜想三:混合固体是氧化铜、 四氧化三铁 猜想四:混合固体是______
(查阅资料):
①Fe3O4能与盐酸反应
②含有Fe3+的盐溶液遇到KSCN(硫氰化钾)溶液时变成红色
③Fe(OH)2是一种白色沉淀,化学性质不稳定,最终转化为红褐色沉淀
(定性探究):
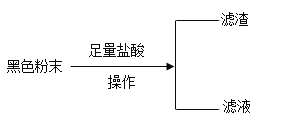
(1)在“操作”中需要用的玻璃仪器有:烧杯、玻璃棒、_____,玻璃棒的作用为_____,所得滤渣为______(填化学式);
(2)取滤液进行如下探究:(表格内填化学式)
实验操作 | 实验现象 | 实验结论 |
步骤一:取一定量的滤液于试管中,加入足量的铁粉 | 无红色固体析出 | 该固体中一定没有____ |
步骤二:又取一定量的滤液于试管中,加入少量的KSCN(硫氰化钾)溶液 | 溶液变成红色 | 滤液中一定含有的物质是______ |
步骤三:再取一定量的滤液于试管中,加入足量的NaOH溶液 | 有红褐色沉淀生成,同时还有少量的白色沉淀生成,白色沉淀迅速变成灰绿色,最终全部变成红褐色 | 滤液中还一定含有的物质是___ |
(讨论交流):
(1)步骤三中滤液里加入氢氧化钠溶液产生红褐色沉淀化学方程式是_____;
(2)通过以上实验,猜想 ________成立;
(3)Fe3O4与盐酸反应时元素的化合价没有改变,请大家推断Fe3O4中铁元素的化合价为____、____;
(4)现取该黑色粉末,经过以下操作,将该粉末中的铁元素全部转化为铁单质:步骤:_____。
(定量分析):
该化学兴趣小组取5g该黑色粉末,加入足量的盐酸后得到0.6g滤渣,则该黑色粉中的其他元素的质量分别是____?(写出计算过程,结果保留一位小数)