题目内容
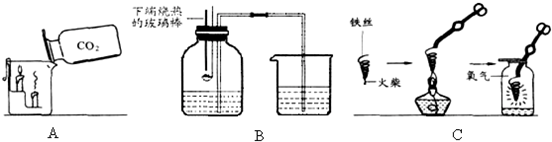
化学实验是学习化学的基础,请根据下列装置图回答问题.
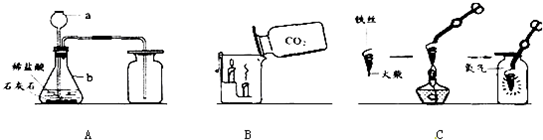
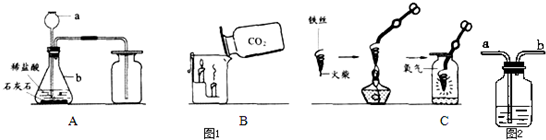
(1)写出仪器a、b的名称a______;b______.
(2)写出A图中产生气体的化学表达式______.
(3)B图中,把二氧化碳气体慢慢倒入放有燃着的蜡烛的烧杯中,下层蜡烛先灭,说明二氧化碳具有______、______、______性质.这一性质在实际生活中的应用为______.
(4)C图中螺旋状铁丝的末端系一根火柴的作用是______.
(5)小明对铁丝在氧气中燃烧为什么会火星四射进行探究.下表是他将纯镁条和不同含碳量的铁丝(镁条和铁丝直径均为0.4mm)放入氧气中燃烧时的实验现象的记录.请你分析回答:
| 物质 | 镁条 | 含碳0.05%的铁丝 | 含碳0.2%的铁丝 | 含碳0.6%的铁丝 |
| 燃烧时 的现象 | 剧烈燃烧,发出 耀眼白光,无火星 | 剧烈燃烧 极少火星 | 剧烈燃烧 少量火星 | (未填)______ ______ |
【答案】分析:(1)实验室常用仪器写出名称;
(2)根据实验室用大理石和稀盐酸反应写出反应化学方程式;
(3)针对实验现象判断二氧化碳的性质;
(4)根据可燃物燃烧的条件,可燃物的温度必须达到着火点;
(5)通过对比可知铁丝含碳越高,火星越多,所以铁丝在氧气中燃烧产生火星四射现象与含碳量有关
解答:解:(1)实验室常用仪器长颈漏斗和锥形瓶;
(2)碳酸钙和氯化氢反应生成氯化钙、水和二氧化碳,反应的化学方程式为:CaCO3+2HCl=CaCl2+CO2↑+H2O;
(3)燃着的蜡烛熄灭说明二氧化碳不燃烧、不支持燃烧,下层蜡烛先熄灭说明二氧化碳的密度比空气大,利用二氧化碳这一性质可以进行灭火.故填:不燃烧;也不支持燃烧;密度比空气大;灭火;
(4)铁丝即便在氧气中也很难直接点燃,所以点燃前必须用容易燃烧的物质引燃;故填:引燃铁丝;
(5)由前三项对比可知铁丝含碳量越高火星越多,所以未填内容应为:剧烈燃烧,火星四射;
由以上探究可知:铁丝在氧气中燃烧产生火星的多少与含碳量有关,所以铁丝在氧气中燃烧产生火星四射现象的原因可能是铁丝中含碳量≥0.6%.故填:剧烈燃烧,火星四射;含碳量.
点评:通过本题的练习需要我们综合掌握物质的制取、性质、以及从题中获取信息的能力,会根据实验现象做出正确的判断和分析.
(2)根据实验室用大理石和稀盐酸反应写出反应化学方程式;
(3)针对实验现象判断二氧化碳的性质;
(4)根据可燃物燃烧的条件,可燃物的温度必须达到着火点;
(5)通过对比可知铁丝含碳越高,火星越多,所以铁丝在氧气中燃烧产生火星四射现象与含碳量有关
解答:解:(1)实验室常用仪器长颈漏斗和锥形瓶;
(2)碳酸钙和氯化氢反应生成氯化钙、水和二氧化碳,反应的化学方程式为:CaCO3+2HCl=CaCl2+CO2↑+H2O;
(3)燃着的蜡烛熄灭说明二氧化碳不燃烧、不支持燃烧,下层蜡烛先熄灭说明二氧化碳的密度比空气大,利用二氧化碳这一性质可以进行灭火.故填:不燃烧;也不支持燃烧;密度比空气大;灭火;
(4)铁丝即便在氧气中也很难直接点燃,所以点燃前必须用容易燃烧的物质引燃;故填:引燃铁丝;
(5)由前三项对比可知铁丝含碳量越高火星越多,所以未填内容应为:剧烈燃烧,火星四射;
由以上探究可知:铁丝在氧气中燃烧产生火星的多少与含碳量有关,所以铁丝在氧气中燃烧产生火星四射现象的原因可能是铁丝中含碳量≥0.6%.故填:剧烈燃烧,火星四射;含碳量.
点评:通过本题的练习需要我们综合掌握物质的制取、性质、以及从题中获取信息的能力,会根据实验现象做出正确的判断和分析.

练习册系列答案
相关题目

 化学实验是学习化学和进行科学研究的重要方法和途径.学会气体物质的制备方法是研究气体、利用气体的基础.请根据图回答有关问题:
化学实验是学习化学和进行科学研究的重要方法和途径.学会气体物质的制备方法是研究气体、利用气体的基础.请根据图回答有关问题: