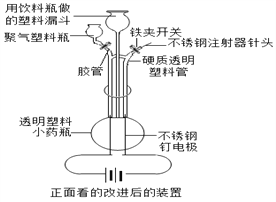
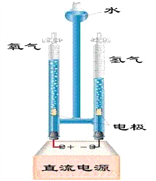
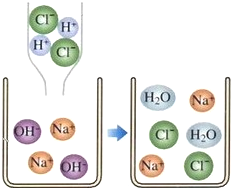
��Ŀ����
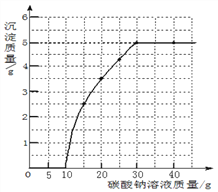
����Ŀ��ʵ�����ù�����ϡ����ʹ���ʯ��ȡCO2��ȡ50g��Ӧ�����Һ����ε���̼������Һ����õ���̼������Һ��������������������Ĺ�ϵ������ͼ��ʾ��
�ش��������⣺
(1)��ͼ�п������ɳ��������������________g��
(2)��ʼ����̼������Һ��10gʱ����û�г�����ԭ����________��
(3)��ͼ�����μ�̼������Һ����Ϊ5gʱ����Һ�е�������_________(д��ѧʽ)
(4)����ԭ��Һ���Ȼ��Ƶ���������Ϊ_______________��(��д���������)
���𰸡� 5 ̼��������ϡ���ᷴӦ HCl��CaCl2��NaCl 11.1%
����������1����ͼ��֪�����ɳ�����������5.0g��
��2����ʼ����̼������Һ��10gʱ����û�г�����ԭ����ԭ��Һ����ʣ���ϡ���ᣬ̼��������ϡ���ᷴӦ ��
��3�����μ�̼������Һ����Ϊ5gʱ��ԭ��Һ�е�ϡ���ỹû�з�Ӧ�꣬��������HCl��û�в��뷴Ӧ���Ȼ��ƣ���̼������ϡ���ᷴӦ���ɵ��Ȼ�����
��4����ԭ��Һ���Ȼ��Ƶ�����Ϊx
CaCl2+ Na2CO3= CaCO3��+2NaCl
111 100
x 5g
![]() =
=![]() x=5.55g
x=5.55g
ԭ��Һ���Ȼ��Ƶ���������Ϊ![]() =11.1%
=11.1%
�����ɳ�����������5.0g��ԭ��Һ���Ȼ��Ƶ���������Ϊ11.1%��

����Ŀ��ѧУ�о���ѧϰС��Ϊ�˲ⶨ���ؿ�ɽʯ��ʯ��̼��Ƶ�����������ȡ����һЩ��ʯ��Ʒ����ȡϡ����200 g��ƽ���ֳ�4�ݽ���ʵ�飬������£�
ʵ�� | һ | �� | �� | �� |
������Ʒ������/g | 5 | 10 | 15 | 20 |
���ɵ�CO2����/g | 1.76 | 3.52 | 4.4 | m |
��1���ϱ���m����ֵ�� ��
��2����Ӧ�п�ʯ��ʣ���ǵ� ��ʵ�飻
��3������ʯ��ʯ����̼��Ƶ����������� ��
��4��ϡ���������ʵ����������� ��