题目内容
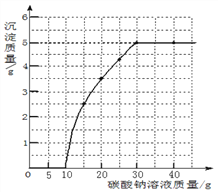
【题目】如图为实验室常用的实验装置,请回答问题

(1)写出装置的名称:①_________,②____________
(2)组装装置完毕,装药前要_________;若用AC装置组合制取氧气,实验中观察到水槽中气泡_______时,开始收集,写出用高锰酸钾制取氧气的化学反应方程式:__________。
(3)二氧化硫是一种具有污染性的气体,实验室用亚硫酸钠固体和浓硫酸来制取,则进行该反应所选用的发生装置是____(填字母),收集二氧化硫选用的是F装置,因此可知二氧化硫的密度______(填“大于”、“小于”或“等于”)空气的密度,F装置中的氢氧化钠溶液要足量,其作用请用化学方程式表示________(用方程式表示)
【答案】 分液漏斗 集气瓶 检查装置的气密性 连续均匀出现 KMnO4![]() K2MnO4+MnO2+O2↑ B 大于 SO2+2NaOH=Na2SO3+H2O
K2MnO4+MnO2+O2↑ B 大于 SO2+2NaOH=Na2SO3+H2O
【解析】(1)根据图示可知:①是分液漏斗,②是集气瓶;(2)组装装置完毕,装药前要先检查装置的气密性,排水法收集氧气时,要等气泡连续均匀冒出再收集,高锰酸钾制取氧气的化学反应方程为:KMnO4![]() K2MnO4+MnO2+O2↑;(3)亚硫酸钠(Na2SO3)固体与稀硫酸在常温下反应,因此不需要加热;二氧化硫的密度比空气的大,溶于水且与水反应生成亚硫酸(H2SO3),因此只能用向上排空气法收集;F装置中的氢氧化钠溶液的目的是吸收二氧化硫,化学方程式为SO2+2NaOH=Na2SO3+H2O。
K2MnO4+MnO2+O2↑;(3)亚硫酸钠(Na2SO3)固体与稀硫酸在常温下反应,因此不需要加热;二氧化硫的密度比空气的大,溶于水且与水反应生成亚硫酸(H2SO3),因此只能用向上排空气法收集;F装置中的氢氧化钠溶液的目的是吸收二氧化硫,化学方程式为SO2+2NaOH=Na2SO3+H2O。

 一线名师权威作业本系列答案
一线名师权威作业本系列答案【题目】同学们尝试获取含有色素的“紫甘蓝提取液”,并探究该提取液能否作为酸碱指示剂。
将撕碎的紫甘蓝叶片用纯净水浸泡,过滤后即可得到蓝色的提取液。
实验1-探究紫甘蓝提取液颜色随溶液pH的变化。
用盐酸、NaOH、水配制一定pH的溶液,分别向其中加入10滴紫甘蓝提取液,溶液的颜色如下。
溶液pH | 2 | 4 | 7 | 10 | 12 |
溶液颜色 | 红 | 红 | 蓝 | 绿 | 绿 |
实验2-用紫甘蓝提取液检测常见溶液的酸碱性。
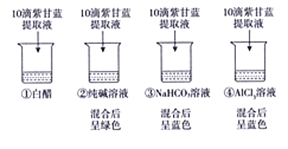
【解释与结论】
(1)紫甘蓝中的色素____(填“能”或“不能”)溶于水。
(2)依据实验现象判断,Na2C03溶液呈____(填“酸性”“中性”或“碱性”)。
(3)若白醋的pH为3,则白醋中滴加紫甘蓝提取液后,混合溶液的颜色为 ___。
(4)根据目前的实验现象,不能断定NaHC03溶液呈中性,理由是____________。
【反思与评价】
(5)同学们查阅资料知AlCl3溶液的pH通常在3—4之间,由此判断实验2中,溶液④呈蓝色不是溶液酸碱性导致的,理由是____________________。
(6)同学们认为紫甘蓝提取液不是良好的酸碱指示剂,原因是____。