题目内容
【题目】课堂上,老师取20g蔗糖放入小烧杯中,加少量水使它润湿,注入10mL浓硫酸,搅拌,同学们看到蔗糖先变黑后“发酵”形成“黑面包”,同时还闻到了刺激性气味,同学们判断黑色固体是碳,原因是浓硫酸具有脱水性。
形成“黑面包”的主要原因是什么?在老师的指导下,同学们开展了探究活动.
(猜想与假设)浓硫酸与碳反应,生成大量气体使黑色固体膨胀.
(查阅资料)
Ⅰ.浓硫酸与碳在加热条件下反应,生成物中有SO2、CO2两种气体.
Ⅱ.SO2是一种具有刺激性气味的气体,能与Ca(OH)2溶液反应生成白色沉淀,也能与高锰酸钾溶液反应。
Ⅲ.SO2能使品红溶液褪色,而CO2不能.
(实验探究)
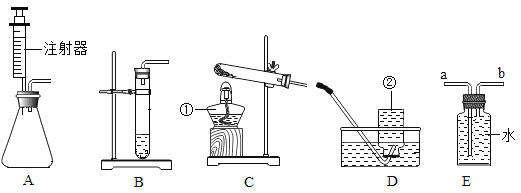
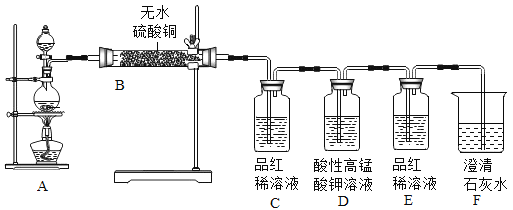
为验证碳与浓硫酸在加热条件下生成的气体产物,同学们在老师指导下设计并进行如图实验:
(事实与结论)
(1)请将能得出对应结论的实验现象填入表中.
验证气体 | 实验现象 | 实验结论 |
SO2 | _________ | 有SO2产生 |
CO2 | _________ | 有CO2产生 |
(2)碳与浓硫酸反应的化学方程式是:___________。
(3)浓硫酸与碳在加热条件下产生大量的SO2和CO2,使黑色固体膨胀,形成“黑面包”,猜想成立.
(反思与交流)
(1)小明同学提出,因老师的演示实验没有进行加热,所以同学们的探究实验无意义,其他同学一致否定了他的说法,理由是:_____________。
(2)在实验中看到B中无水硫酸铜变蓝,请写出B中反应的化学方程式:________。
(3)D中酸性高锰酸钾溶液的作用是:________, E中品红溶液的作用是:______。
【答案】C中品红溶液褪色 E中品红溶液不褪色,F中澄清石灰水变浑浊 C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O 浓硫酸溶于水放出大量的热,不加热也可进行 CuSO4+5H2O =CuSO4·5H2O 吸收SO2,防止干扰CO2检验 检验SO2是否被完全吸收,以免对二氧化碳的检验产生干扰
CO2↑+2SO2↑+2H2O 浓硫酸溶于水放出大量的热,不加热也可进行 CuSO4+5H2O =CuSO4·5H2O 吸收SO2,防止干扰CO2检验 检验SO2是否被完全吸收,以免对二氧化碳的检验产生干扰
【解析】
事实与结论:
(1)浓硫酸与碳在加热条件下反应,生成物中有SO2、CO2两种气体。SO2能使品红溶液褪色,如果C中品红溶液褪色,说明有SO2产生;而SO2和CO2均能使E中澄清石灰水变浑浊,所以E中品红溶液不褪色,说明无SO2,F中澄清石灰水变浑浊,说明有CO2产生;
(2)C与浓硫酸在加热条件下,发生反应生成二氧化碳、二氧化硫和水,方程式为:C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O;
CO2↑+2SO2↑+2H2O;
反思与交流:
(1)小明同学提出,因老师的演示实验没有进行加热,所以同学们的探究实验无意义,其他同学一致否定了他的说法,理由是浓硫酸溶于水放出大量的热,不加热也可进行;
(2在实验中看到B中无水硫酸铜变蓝,发生的反应是硫酸铜与水反应生成硫酸铜晶体,反应的化学方程式:CuSO4+5H2O =CuSO4·5H2O;
(3)D中酸性高锰酸钾溶液的作用是吸收SO2,防止干扰CO2检验;E中品红溶液的作用是检验SO2是否被完全吸收,以免对二氧化碳的检验产生干扰。

 全优点练单元计划系列答案
全优点练单元计划系列答案【题目】结合下表给出的![]() 和
和![]() 的溶解度,回答下列问题:
的溶解度,回答下列问题:
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度/g |
| 13.3 | 31.6 | 63.9 | 110 | 169 | 245 |
| 35.7 | 36.0 | 35.6 | 37.3 | 38.4 | 33.8 | |
(1)20℃时,将40g ![]() ,加入100g水中,所得溶液的质量为_____g;
,加入100g水中,所得溶液的质量为_____g;
(2)这两种物质中溶解度受温度变化影响较小的是_____;
(3)将90g ![]() 和30g
和30g![]() 组成的混合物放入100g60℃的水中充分搅拌,当温度降低到20℃时,发现有较多固体析出,下列说法中,正确的是_____。
组成的混合物放入100g60℃的水中充分搅拌,当温度降低到20℃时,发现有较多固体析出,下列说法中,正确的是_____。
A 析出的固体是![]() B 剩余的母液中含有
B 剩余的母液中含有![]() 和
和![]() 两种溶质
两种溶质