题目内容
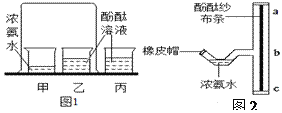
【题目】某兴趣小组用图1装置进行实验时发现:烧杯中饱和石灰水先变浑浊,后逐渐澄清。

(1)写出甲装置中发生反应的化学方程式______________;
(2)为探究“饱和和石灰水浊后变澄清的原因”,该小组同学开展了如下活动:
(查阅文献)碳酸钙钙(碳酸钠等)与二氧化碳、水反应生成可溶于水的碳酸氢钙(碳酸氢钠等)。
(提出假设)假设1:二氧化碳与碳酸钙、水发生反应生成碳酸氢钙;
假设2:___________________;
(设计实验)为除去CO2中的氯化氢气体,小华在图1中甲、乙装置之间增加图2装置,装置的连接顺序是甲→_______→_______→乙(填字母序号);其中放的试剂合理的是_________(填选项序号:A.浓硫酸 B.NaOH溶液液 C.饱和 NaHCO3溶液;)
(实验现象)饱和石灰水浑浊后,继续通入足量CO2,沉淀部分溶解但最终并未完全澄清。
(得出结论)假设2成立;
(3)同学们在老师指导下仍用图1所示装置进行实验,但同时用pH传感器监测烧杯中溶液的pH,所得图像如图3所示;
①AB段pH几乎不变的原因可能是____________________;
D点处溶液的溶质主要有(填化学式)_______________________;
②BC段主要发生两个化学反应:a二氧化碳与澄清石灰水反应;b(写出化学方程式)________。
【答案】 CaCO3+2HCl==CaCl2+H2O+CO2↑ 挥发出的HCl气体进入乙烧杯中溶解生成的碳酸钙 b a C 一开始排出来的是空气进入到了乙烧杯中,对pH基本没有影响 CaCl2和HCl HCl+Ca(OH)2==CaCl2+H2O
【解析】(1)根据碳酸钙与盐酸反应生成氯化钙、水和二氧化碳解答;【提出假设】根据挥发出的HCl气体进入乙烧杯中分析解答;【设计实验】根据为除去CO2中的HCl,那么就要使气体与药品充分接触解答;根据要除去二氧化碳中的氯化氢气体应用饱和的碳酸氢钠溶液解答;【得出结论】(3)①由于一开始排出来的是空气,不发生反应,故pH不变;②根据D点所得溶液的pH<7,即溶液呈酸性分析解答;②根据盐酸与氢氧化钙溶液反应生成氯化钙和水解答。(1)甲装置中是碳酸钙与盐酸反应生成氯化钙、水和二氧化碳,反应的化学方程式CaCO3+2HCl=CaCl2+H2O+CO2↑;【提出假设】可能是甲中挥发出的HCl气体进入乙烧杯中溶解生成的碳酸钙;【设计实验】为除去CO2中的HCl,那么就要使气体与药品充分接触,故连接顺序是甲→b→a→乙;要除去二氧化碳中的氯化氢气体应用饱和的碳酸氢钠溶液,故选C;【得出结论】(3)①由于一开始排出来的是空气进入到了乙烧杯中,对pH基本没有影响;由图可知,D点时pH<7,溶液呈酸性,故溶液的溶质主要有CaCl2和HCl(从甲中挥发的氯化氢气体进入到乙中形成的盐酸与氢氧化钙反应生成的氯化钙和过量的盐酸)。②盐酸与氢氧化钙溶液反应生成氯化钙和水,反应的化学方程式为HCl+Ca(OH)2=CaCl2+H2O。

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案【题目】下图是一种树状分类的运用实例,下表所列的分类与下下图分类不相符的是
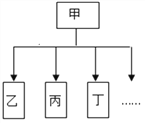
选项 | 甲 | 乙 | 丙 | 丁 | … |
A | 营养素 | 蛋白质 | 糖类 | 维生素 | … |
B | 单质 | 金刚石 | 水银 | 干冰 | … |
C | 溶液 | 碘酒 | 糖水 | 氨水 | … |
D | 化肥 | 氮肥 | 磷肥 | 钾肥 | … |
A. A B. B C. C D. D
【题目】下列对某一主题的知识归纳,全部正确的一组是
A.水资源 | B.化学与健康 |
废水——生活污水直接排放 硬水和软水——可用肥皂水来检验 | 人体缺乏维生素B——引起坏血病 铁、锌、钙元素——都是人体必须的微量元素 |
C.微观粒子 | D. 食品安全 |
春天处处闻花香——分子在不停运动 硫离子结构示意图为: | 工业酒精——含有甲醇等有毒物质,不能饮用 黄曲霉素(C17H12O6)——属于有机物,食用霉变后含有黄曲霉素的食物可能诱发癌变 |
A. A B. B C. C D. D