题目内容
【题目】如图所示,将一个新鲜的鸡蛋放入水中,鸡蛋沉入水中,加入适量稀盐酸后,鸡蛋会出现上浮、下沉再上浮、再下沉的现象,反复多次,且观察到鸡蛋上有气泡产生,某实验小组对该实验产生了兴趣,于是进行了如下探究。
(一)定性分析
[查阅资料]鸡蛋壳含有钙元素。
[实验步骤及现象]取一些鸡蛋壳于一支洁净的试管中,加入过量稀盐酸,产生无色无味的气体,将该气体通入澄清石灰水中,石灰水变浑浊。
[实验结论及分析](1)鸡蛋壳的主要成分是:_________。
(2)写出澄清石灰水变浑浊的化学反应方程式:_________。
(二)定量分析
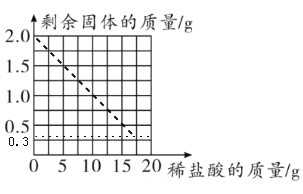
取2.00g鸡蛋壳样品,把20.00g稀盐酸分四次加入样品中,充分反应后过滤,取滤渣,洗涤、干燥、称量,得到的实验数据如表所示:
稀盐酸的用量 | 剩余固体的质量 |
第一次加入5g | 1.5g |
第二次加入5g | 1.0g |
第三次加入5g | 0.5g |
第四次加入5g | 0.3g |
(1)根据表中数据画出所用稀盐酸的质量与剩余固体质量的关系图。_______
(2)从以上数据可知,这四次实验中,第_______次鸡蛋壳样品中主要成分完全反应。
(3)根据所绘曲线,计算鸡蛋壳中主要成分的质量分数为_____,所用稀盐酸的溶质质量分数为_____(结果精确到0.1% )。
(三)废液处理与反思
(1)由上述实验数据可知,实验结束后得到的滤液呈酸性,直接排放会造成管道腐蚀或污染环境,可向滤液中加入_______(填物质名称)调至滤液呈中性后再排放。
(2)食品中添加碳酸钙有助于防止人体缺钙引起的________(填“骨质疏松症”或“贫血”)。
【答案】碳酸钙(或CaCO3) ![]()
 四 85% 7.3% 氢氧化钙(其他合理答案均可) 骨质疏松症
四 85% 7.3% 氢氧化钙(其他合理答案均可) 骨质疏松症
【解析】
(一)(1)鸡蛋壳中加入稀盐酸,反应产生二氧化碳,说明鸡蛋壳中含有碳酸盐,根据鸡蛋壳含有钙元素,所以鸡蛋壳的主要成分是碳酸钙;
(2)二氧化碳使澄清石灰水变浑浊的反应原理为![]() ;
;
(二)(1)分析表中数据可知5g稀盐酸完全反应,固体质量减少0.5 g,所以加入17g稀盐酸时,样品中碳酸钙完全反应,剩余固体的质量为0.3 g,据此可画出图像;
(2)分析表中数据可知5g稀盐酸完全反应,固体质量减少0.5g,第四次加入5 g稀盐酸,固体质量只减少![]() ,说明稀盐酸没有完全反应,即第四次加人稀盐酸后样品中的碳酸钙完全反应;
,说明稀盐酸没有完全反应,即第四次加人稀盐酸后样品中的碳酸钙完全反应;
(3)由图可知,鸡蛋壳中杂质的质量为0.3 g,所以碳酸钙的质量为![]() ,鸡蛋壳中碳酸钙的质量分数为
,鸡蛋壳中碳酸钙的质量分数为![]() ;要计算稀盐酸的溶质质量分数应该利用盐酸完全反应的数据,分析表中数据可知,第一次、第二次、第三次加入的稀盐酸均已完全反应,第四次加入的稀盐酸过量,即可利用第一次或第二次或第三次实验的数据进行计算,现利用第一次实验数据计算,设5g稀盐酸中溶质的质量为x,
;要计算稀盐酸的溶质质量分数应该利用盐酸完全反应的数据,分析表中数据可知,第一次、第二次、第三次加入的稀盐酸均已完全反应,第四次加入的稀盐酸过量,即可利用第一次或第二次或第三次实验的数据进行计算,现利用第一次实验数据计算,设5g稀盐酸中溶质的质量为x,

![]()
x=0.365g
则所用稀盐酸的溶质质量分数为![]() ;
;
(三)(1)废液呈酸性,废液中含有盐酸,要将废液处理成中性,可加入碱,如氢氧化钙、氢氧化钠等,也可加入氧化钙或石灰石等,答案合理即可;
(2)人体缺钙易引起骨质疏松症,而缺铁易引起贫血,所以填骨质疏松症。

【题目】下表是四种常见的天然色素,回答下列问题:
名称 | 叶绿素b | 叶黄素 | 姜黄素 | 甜菜红 |
化学式 | C55H70MgN4O6 | C40H56O2 | C21 H20O6 | C24 H26N2O13 |
性质 | 不溶于水,可溶于乙醇等溶剂;稳定性不好,光、酸、碱、氧化剂等都能使其分解 | 不溶于水,易溶于油脂;耐热性能好,但对 光和氧不稳定 | 不溶于水,溶于乙醇;耐光性和耐热性较差 | 易溶于水,不溶于油脂;耐热性较差 |
(1)有机化合物中也可能含有金属元素,如叶绿素b中含有______________________________(填元素名称)元素。
(2)姜黄素中碳、氢、氧三种元素的原子个数比为______________________________。
(3)根据表中信息,可推测出保存甜菜红的方法是______________________________(写出一条即可)。
(4)计算叶黄素中氧元素的质量分数为______________________________(精确到0.1%)。
(5)绿色植物可利用体内的叶绿素通过光合作用将二氧化碳转化为氧气, 请指出该反应在人类生活中的重要作用:______________________________(写出一条即可)。