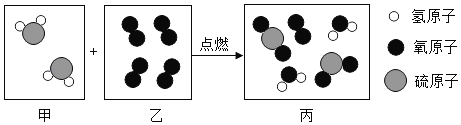
题目内容
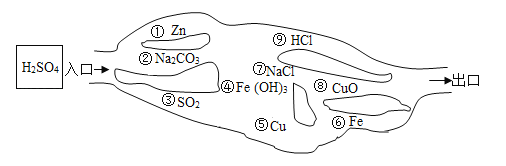
【题目】硫酸铜晶体常用作农业和渔业的杀虫剂、杀菌剂。以下是由废铜料(含铁)生产硫酸铜晶体的流程。

(1) B的化学式为________,操作a的名称是________。
(2)②的反应基本类型为___________;反应①、③的化学方程式分别为①______________;③______________。
(3)已知:![]() 从环保和经济的角度分析,对比途径I、Ⅱ,途径I的优点有:不产生有害气体和_______________。
从环保和经济的角度分析,对比途径I、Ⅱ,途径I的优点有:不产生有害气体和_______________。
【答案】CuO 过滤 化合反应 Fe+H2SO4=FeSO4+H2↑ CuO+ H2SO4=CuSO4+H2O 硫酸的利用率高
【解析】
试题(1)黑色固体为金属铜在加热条件下与氧气化合产生的氧化铜,操作a为过滤操作,把不与稀硫酸反应的金属铜与硫酸亚铁溶液分离开来,故答案为CuO,过滤,
(2)反应②,加热条件下金属铜与氧气化合生成氧化铜,反应①则是铁与稀核酸反应生成硫酸亚铁和氢气,反应③为黑色氧化铜与稀硫酸反应生成硫酸铜和水,
故答案为化合反应;Fe+H2SO4=FeSO4+H2↑;CuO+H2SO4=CuSO4+H2O,
(3)途径II产生的二氧化硫既会污染环境,又使硫酸不能全部转化为产品硫酸铜而形成浪费。

 名校课堂系列答案
名校课堂系列答案【题目】工业上常利用电石制乙炔气体![]() 时产生的灰浆和残渣制备化工原料
时产生的灰浆和残渣制备化工原料![]() 和超细
和超细![]() .
.
![]() 电石制乙炔气体
电石制乙炔气体![]() 时产生灰浆和残渣的过程如下:电石
时产生灰浆和残渣的过程如下:电石![]() 灰浆
灰浆![]() 残渣,其中电石与水反应生成氢氧化钙和乙炔,写出该反应的化学方程式 ______,残渣中主要成分是
残渣,其中电石与水反应生成氢氧化钙和乙炔,写出该反应的化学方程式 ______,残渣中主要成分是![]() 和 ______ .
和 ______ .
Ⅰ![]() 制备
制备![]() 的流程如图:
的流程如图:
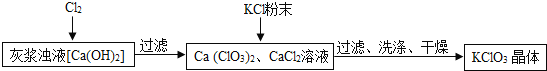
![]() 向灰浆浊液中通入
向灰浆浊液中通入![]() ,得到
,得到![]() 、
、![]() 溶液.反应中
溶液.反应中![]() 与
与![]() 的化学计量数分别为1和
的化学计量数分别为1和![]() 写出此反应的化学方程式 ______ .
写出此反应的化学方程式 ______ .
![]() 有关物质在常温下的溶解度如下:
有关物质在常温下的溶解度如下:
物质 |
|
|
| KCl |
溶解度 |
|
|
|
|
上述流程中加入KCl粉末,KCl与 ______ ![]() 填化学式
填化学式![]() 发生了复分解反应,得到
发生了复分解反应,得到![]() 晶体.你认为能得到
晶体.你认为能得到![]() 晶体的原因是 ______ .
晶体的原因是 ______ .
![]() 洗涤时,可选用下列洗涤剂 ______
洗涤时,可选用下列洗涤剂 ______ ![]() 填字母编号
填字母编号![]() .
.
A KCl饱和溶液![]() 冰水
冰水![]() 饱和
饱和![]() 溶液
溶液
Ⅱ![]() 制备超细
制备超细![]() 的流程如下
的流程如下![]() 注:加入
注:加入![]() 溶液的目的是溶解残渣中的难溶盐
溶液的目的是溶解残渣中的难溶盐![]() :
:
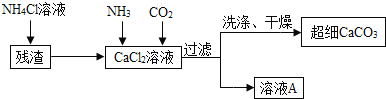
![]() 向
向![]() 溶液中通入两种气体,生成超细
溶液中通入两种气体,生成超细![]() 的化学方程式 ______
的化学方程式 ______ ![]() 检验
检验![]() 是否洗涤干净的方法是 ______ .
是否洗涤干净的方法是 ______ .
![]() 流程中溶液A可循环使用,其主要成分的化学式是 ______ .
流程中溶液A可循环使用,其主要成分的化学式是 ______ .
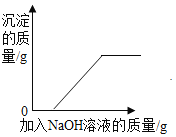
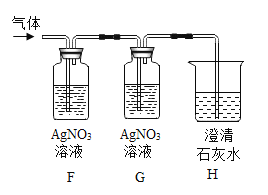
【题目】某同学发现,上个月做实验用的NaOH溶液忘记了盖瓶盖.对于该溶液是否变质,同学们开始实验探究.
(猜想假设)
猜想(1):该溶液没有变质,为NaOH溶液.
猜想(2):该溶液全部变质,为Na2CO3溶液.
猜想(3):该溶液部分变质,为NaOH和Na2CO3的混合溶液.
(查阅资料)Na2CO3溶液呈碱性
(设计方案)请你完善下表几组同学探讨的设计方案
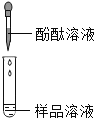
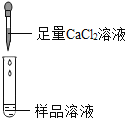
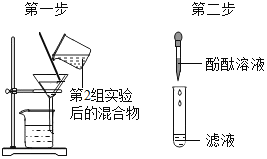
实验操作 | 可能出现的现象与结论 | 同学评价 | |
第1组 |
| 若溶液变红,则猜想(2)不成立 | 第2组同学认为:此方案结论不正确,理由是:__. |
第2组 |
| 若产生白色沉淀,反应方程式是:_____ 则猜想(1)不成立. | 第3组同学认为:此方案还不能确定猜想(2)还是猜想(3)成立. |
第3组 |
| 若滤液不变红,则猜想(2)成立;若滤液变红,则猜想(3)成立. | 第1组同学认为:不需过滤也能达到实验目的,更简单的操作方法是:_____ |
(探究实验)综合各小组的方案后,动手实验.
(结论与反思)(1)NaOH溶液易与空气中_____反应而变质,为防止变质,所以保存时要_____.
(2)第二组实验中,产生沉淀的方程式为:_____.