题目内容
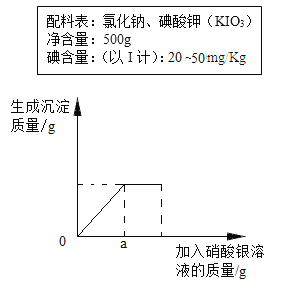
【题目】碘元素对人体健康具有重要作用,我国推广使用的碘盐是在食盐中加入一定量的碘酸钾(KIO3),如图是某碘盐标签的一部分。为了测定该食盐中氯化钠的含量,甲、乙、丙三位同学分别进行实验,实验恰好完全反应的图像及数据如下,请回答下列问题:
甲 | 乙 | 丙 | |
所取固体样品的质量(g) | 20 | 10 | 10 |
加入硝酸银溶液的质量(g) | 100 | 100 | 150 |
反应后所得的沉淀的质量(g) | 23.06 | 23.06 | 23.06 |
(1)成年人缺碘易导致_____________,曲线中a的数值是______________。
(2)碘酸钾受热易分解,则在使用加碘盐时应注意__________,根据标签信息计算,加碘盐中碘酸钾的含量最多为_________mg/kg(保留到小数点后一位)。
(3)计算该食盐中氯化钠的质量分数__________(结果精确至0.1%)。
【答案】甲状腺肿大 100 避免长时间加热或高温烹饪 84.3 94.0%
【解析】
由表格中三位同学的实验数据及图像分析知,乙同学所取固体中的氯化钠与硝酸银恰好完全反应,a为硝酸银溶液的质量,a=100;由表格中沉淀的质量,利用化学方程式计算出10g固体中氯化钠的质量,从而可以求出食盐中氯化钠的质量分数。
(1)成年人缺碘容易得甲状腺肿大;由上述分析可知,a=100。
(2)当食盐中含碘量最多时,即m(I)=50 mg/kg,碘酸钾的含量最多,设加碘盐中碘酸钾的含量最多为y,根据关系式:
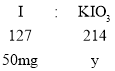
![]()
y![]() 84.3mg/kg
84.3mg/kg
(3)解:由表格数据可知,乙同学的实验恰好完全反应,设该食盐样品中氯化钠的质量为x。
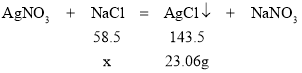
![]()
x≈9.40g
该食盐中氯化钠的质量分数为![]()
答:该食盐中氯化钠的质量分数约为94.0%。

【题目】将一定质量的a、b、c、d四中物质放入一密闭容器中,.在一定条件下反应一段时间后,测得反应后各物质的质量如下表。下列说法正确的是
物质 | a | b | c | d |
反应前质量/g | 6.40 | 3.20 | 4.00 | 0.50 |
反应后质量/g | 待测 | 2.56 | 7.20 | 0.50 |
A. a和b是反应物,d是催化剂
B. 反应后a物质的质量为4.64g
C. 物质中元素的种类,和a、b两种物质中元素的种类不同
D. 若a物质与b物质的相对分子质量之比为2:1 ,则反应汇总a和b的化学计量数之比一定是2:1