题目内容
【题目】某兴趣小组用图I装置进行实验时发现,烧杯中饱和石灰水先变浑浊,后逐渐澄清。
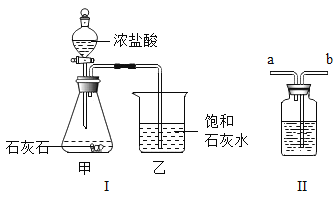
(1)甲装置中发生反应的化学方程式是_____;乙装置中石灰水先变浑是因为生成了碳酸钙。
(2)为探究“饱和石灰水浑浊后变澄清的原因”,同学们开展了如下活动:
[查阅文献]碳酸钙(碳酸钠等)与二氧化碳、水反应生成可溶于水的碳酸氢钙(碳酸氢钠等)。
[提出假设]假设1:挥发出的HCl使浑浊变澄清;
假设2:_____。
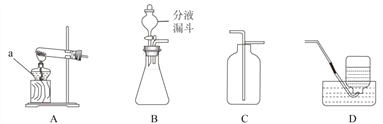
[设计实验]为除去CO2中的HCl,小华在图I中甲、乙装置之间增加图II装置,装置的连接顺序是甲→_____(填管口字母)→_____(填管口字母)→乙,其中存放的试剂合理是_____(填序号)。
A 浓硫酸
B 饱和Na2CO3溶液
C NaOH溶液
D 饱和NaHCO3溶液
[实验现象]饱和石灰水浑浊后,继续通入足量CO2,沉淀部分溶解但最终并未完全澄清。
[得出结论]由以上探究可得出的结论是_____(填:“假设1”或“假设2”)成立。
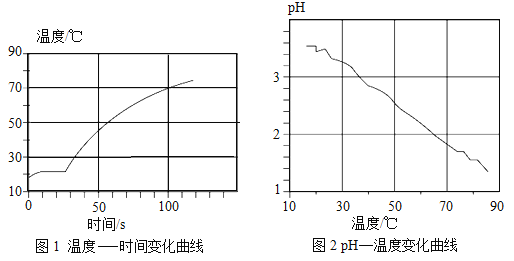
(3)同学们在老师指导下,用pH传感器测得图I烧杯中溶液的pH随通入气体时间的变化曲线如图所示。
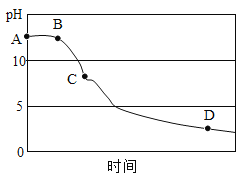
①AB段pH不变的可能原因是_____。
②BC段发生反应的化学方程式主要有_____。
③D点所得溶液的成分除H2O外还有_____。
【答案】2HCl+CaCO3=CaCl2+CO2↑+H2O 产生的CO2使浑浊变澄清 b a D 假设1 一开始排出来的是空气,不会使溶液pH明显变化 Ca(OH)2+CO2=CaCO3↓+H2O、2HCl+Ca(OH)2=CaCl2+2H2O CaCl2和HCl(或Ca2+、H+、Cl-)
【解析】
(1)甲装置中石灰石的主要成分碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳,反应的化学方程式是:CaCO3+2HCl=CaCl2+H2O+CO2↑。
(2)[提出假设]由文献资料,碳酸钙(碳酸钠等)与二氧化碳、水反应生成或可溶于水的碳酸氢钙,则可提出假设产生的二氧化碳使石灰水变澄清。
[设计实验]图中装置起洗气功能时进气管与出气管的方向是“长进短出”,小华在图1中甲、乙装置之间增加图2装置,装置的连接顺序是甲→b→a;其中盛放的试剂合理的是碳酸氢钠,碳酸氢钠能与氯化氢气体反应生成氯化钠、水和二氧化碳,能除去杂质且没有引入新的杂质,符合除杂原则。
[得出结论]饱和石灰水浑浊后,继续通入足量CO2,沉淀部分溶解但最终并未完全澄清,而挥发出来的氯化氢使饱和石灰水产生的浑浊最终变澄清;二氧化碳只能使饱和石灰水生成的沉淀部分溶解,不能最终使其变澄清。
(3)①刚开始排出的气体是空气,故AB段pH几乎不变。
②BC段,二氧化碳与氢氧化钙反应生成碳酸钙沉淀和水,氯化氢与氢氧化钙反应生成氯化钙和水,反应的化学方程式主要有CO2+Ca(OH)2═CaCO3↓+H2O、Ca(OH)2+2HCl═CaCl2+2H2O。
③D点溶液的pH小于5,所得澄清溶液的成分除H2O外,还有氯化氢气体溶于水生成的盐酸,氯化氢与氢氧化钙反应生成生成的氯化钙。
故答案为:(1)CaCO3+2HCl=CaCl2+H2O+CO2↑;
(2)[提出假设]产生的二氧化碳使石灰水变澄清;
[设计实验]b;a;D;
[得出结论]假设1
(3)①一开始排出来的是空气,不会使溶液pH明显变化
②Ca(OH)2+CO2═CaCO3↓+H2O2HCl+Ca(OH)2═CaCl2+2H2O
③CaCl2和HCl(或Ca2+、H+、Cl-)

【题目】某燃煤发电厂开始运行后,该厂附近玉米产量急剧下降.经检测发现:当地雨水pH约4.0.土壤pH约5.0.已知一些主要作物最适宜生长的土壤的pH如表:
作物 | 水稻 | 小麦 | 玉米 | 油菜 | 马铃薯 |
pH | 6~7 | 6.3~7.5 | 6~7 | 6~7 | 4.8~5.5 |
(1)根据数据,该土壤最适合种植的作物是_____.
(2)若继续种玉米,你认为最好选用下列_____试剂来改良土壤.
A 硝酸钾 B 熟石灰 C 石灰石 D 尿素
(3)该地区形成酸雨的主要原因为燃煤中产生的_____所致.
(4)下列防止空气污染的措施中,错误的是_____.
A 大量植树造林 B 控制烟花爆竹燃放
C 开发和利用清洁能源 D 垃圾运到远离城市再焚烧
(5)为减少二氧化碳等温室气体的排放,科学家采取“组合转化”技术,将二氧化碳和氢气在催化剂和加热条件下转化为一种重要的化工原料乙烯(C2H4)和水,该反应的化学方程式为_____.