��Ŀ����
����Ŀ����������װ��ͼ���ش��й����⡣
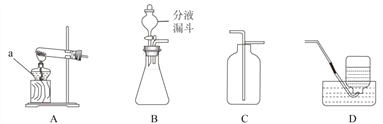
(1)д��װ��ͼ�б�����������ƣ�a____��
(2)ʵ�����ø��������ȡ��������Ӧ�Ļ�ѧ����ʽ�� ___________________________________________________________________ ����ѡ�õķ���װ����___________________(����ĸ)��
(3)ʵ������п��ϡ������ȡ��������Ӧ�Ļ�ѧ����ʽΪ ________________________________________ ��
��ѡ�õ��ռ�װ���� ___________________(����ĸ)����װ�� B �з�Ӧ���ң���ʵ�鰲ȫ�Ƕȿ��ǣ����˲�ȡ�Ĵ�ʩ�� ___________________(�����)��
�����ݻ���С����ƿ �������μ�Һ����ٶ�
�����ȷ�Ӧ�� ������Һ�巴Ӧ���Ũ��
(4)ʵ������������������Ϊ 5%�Ĺ���������Һ��ȡ��������Ҫ�õ� 0.8g ������������Ҫ����������Һ�� ������_________��(д���������)
���𰸡��ƾ��� 2KMnO4![]() K2MnO4+MnO2+O2�� A Zn+H2SO4=ZnSO4+H2�� D �٢� 34g
K2MnO4+MnO2+O2�� A Zn+H2SO4=ZnSO4+H2�� D �٢� 34g
��������
������Ҫ�����������ơ���ѧ����ʽ����д��ʵ��װ�õ�ѡ���ݻ�ѧ����ʽ�ļ��㡣ѡ����װ��ʱ��Ҫ���Ƿ�Ӧ���״̬����Ӧ���������أ�ѡ���ռ�װ��ʱ��Ҫ���������ˮ���ԡ��ܷ��ˮ������ѧ��Ӧ���ܶȡ��ܷ�Ϳ����е����ʷ�����ѧ��Ӧ�����ء�
��1��aΪ�ƾ��ƣ�
��2��ʵ�����ø��������ȡ�������Ǹ���������ȷֽ�Ϊ����ء��������̺���������Ӧ�Ļ�ѧ����ʽ��2KMnO4![]() K2MnO4+MnO2+O2�����ǹ��������ȡ���壬��ѡ�õķ���װ���� A��
K2MnO4+MnO2+O2�����ǹ��������ȡ���壬��ѡ�õķ���װ���� A��
��3��ʵ������п��ϡ������ȡ��������п�����ᷴӦ��������п����������Ӧ�Ļ�ѧ����ʽ�� Zn+H2SO4=ZnSO4+H2��������������ˮ�����Կ�ѡ�õ��ռ�װ���� D����װ��B�з�Ӧ���ң���ʵ�鰲ȫ�Ƕȿ��ǣ������ݻ���С����ƿ �ᵼ�����Ͳ��ܵõ��ͷţ������ױ�ը���ڼ����μ�Һ����ٶȣ����Լ�����Ӧ���ʣ���ֹ������ը���ۼ��ȷ�Ӧ����·�Ӧ���죬���ױ�ը���ܽ���Һ�巴Ӧ���Ũ�ȣ����ٷ�Ӧ��Ӵ�����Ӧ���������ͱ�ը���ա���ѡ�٢ۣ�
��4���裺������Ҫ����������Һ������Ϊx��
2H2O2 ![]() 2H2O+O2��
2H2O+O2��
68 32
5%x 0.8g
![]() x=34g
x=34g
��������Ҫ����������Һ34 g��