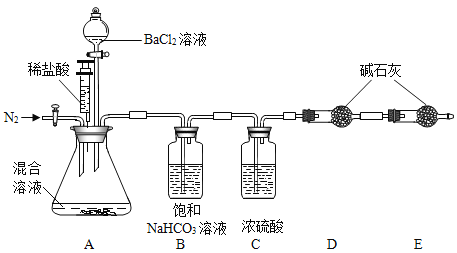
题目内容
【题目】在日常生活中我们经常会使用金属材料.
(1)铝及其合金常用作于高压电缆,主要利用了铝优良的____.
(2)铝在空气中容易形成一层致密的氧化膜,从而保护铝不会进一步地被氧化.请用化学方程式表示该氧化膜的形成过程_____.
(3)不锈钢是生活中常用的合金,不锈钢的主要成分有铁、铬、镍.其中,铬的金属活动性与铁相近,常见化合价为+3、+6和+2,回答以下与金属铬(Cr)相关的问题.
①铬+3价的氧化物化学式为Cr2O3,读作_____.
②将铬丝插入下列溶液没有明显现象的是_____(填序号)
A AgNO3溶液 B H2SO4溶液 C NaCl溶液 D NaOH溶液
③CrCl3水溶液呈深绿色,它由深绿色难溶于水的氢氧化铬Cr(OH)3与盐酸作用制得.写出上述制取CrCl3的化学方程式______,预测反应现象______.
【答案】导电性 ![]() 三氧化二铬 CD
三氧化二铬 CD ![]() 深绿色固体消失,溶液呈深绿色
深绿色固体消失,溶液呈深绿色
【解析】
(1)铝及其合金常用作于高压电缆,主要利用了铝优良的导电性;故填:导电性;
(2)铝的化学性质比较活泼,在常温下,能与空气中的氧气反应,在其表面形成一层致密的氧化铝薄膜,故该反应的化学方程式为:![]() ;
;
(3)①由两种元素组成的化合物的名称一般读作某化某,故Cr2O3读作三氧化二铬,故填:三氧化二铬;
②A、铬的金属活动性与铁相近,因此比银的活动性强,可以置换出银,在铬的表面产生银白色的金属,不符合题意;
B、铬的金属活动性与铁相近,因此位于氢前,能够和稀硫酸反应产生氢气,观察到有气泡产生,不符合题意;
C、铬的活动性和铁相近,因此比钠的活动性弱,不能和氯化钠发生置换反应,无现象,符合题意;
D、金属铬不能和碱溶液发生反应,因此无明显现象,符合题意;
故选CD;
③氢氧化铬Cr(OH)3与盐酸反应生成三氯化铬和水,该反应的化学方程式为:![]() ; 氢氧化铬为深绿色固体,三氯化铬是深绿色的溶液,故实验现象为:深绿色固体消失,溶液呈深绿色。
; 氢氧化铬为深绿色固体,三氯化铬是深绿色的溶液,故实验现象为:深绿色固体消失,溶液呈深绿色。