题目内容
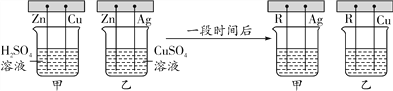
【题目】欲测定 Cu-Zn 合金及 Cu-Ag 合金中铜的质量分数,实验室只提供一瓶未标明浓度的稀 H2SO4 和必要的仪器.为了测定合金的组成,某同学取四份合金样品分别加人稀 H2SO4 充分反 应,得到如下实验数据:


(1)你认为能测出质量分数的合金是______。
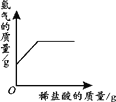
(2)第 4 份产生的气体的质量是______。
(3)所加稀 H2SO4 的浓度是多少_______?
【答案】 Cu-Zn合金 1.0g 9.8%
【解析】(1)铜的活动性比氢弱,不与稀酸发生反应,锌的活动性比氢强,能与稀酸发生反应,因而铜锌合金能测定出铜的质量分数;而银的活动性比氢弱,也不与稀酸发生反应,因而铜银合金不能测定出铜的质量分数;(2)根据表中数据可知:每150g稀流酸可以产生0.3g氢气,再结合图象可知:第4份产生的气体的质量是1g;
(3)每150g稀流酸可以产生0.3g氢气,
设150g稀流酸中溶质质量为x,
Zn+H2SO4=ZnSO4+H2↑
98 2
x 0.3g
![]()
x=14.7g,
所加稀H2SO4的浓度是![]() ×100%=9.8%;
×100%=9.8%;
答:所加稀H2SO4的浓度是9.8%。

练习册系列答案
相关题目
【题目】下列4个图像能正确反映对应变化关系是( )
A | B | C | D |
|
|
|
|
向一定量铁粉中滴加稀盐酸液 | 用酒精灯加热一定量KMnO4固体 | 向一定量澄清石灰水中加入Na2CO3溶液 | 向盛有MnO2的烧杯中加入H2O2溶液 |
A. A B. B C. C D. D