题目内容
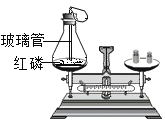
【题目】为测定某市售CaCO3药品中CaCO3的质量分数(杂质为SiO2,与稀HCl不反应),某同学的方法是:将样品与稀盐酸反应,测定反应后生成的CO2质量,再根据CO2的质量求出样品中CaCO3的质量,从而计算出样品中CaCO3的质量分数。为测定生成CO2的质量,他设计了如图的实验方案(已知;无水氯化钙是常见的干燥剂):
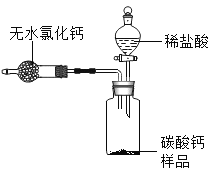
(1)按图组装好装置。检查装置气密性后.在分液漏斗中加入过量稀HCl,并在干燥管中加人适量无水氯化钙固体,称得装置和药品的总质量为564.57g;
(2)在广口瓶中加入CaCO3样品,称得装置和药品的总质最为574.57g;
(3)旋紧橡皮塞,打开分液漏斗旋塞,向广口瓶中滴加稀HCl,使样品与稀HCl完全反应;
(4)反应结束后,称得装置及装置内所有物质的总质量为570.57g。请根据上述实验回答下列问题:
①该方案测得样品中CaCO3的质量分数是_____?(写出解题过程,计算结果精确到0.1%)
②该实验中用稀HCl与CaCO3样品反应,而不用浓HCl与CaCO3样品反应,其原因是_____。实验中无水氯化钙的作用是_____,若实验中不用无水氯化钙,则测得样品中CaCO3的质量分数与上述实验计算结果相比_______(选填“偏小”或“不变”或“偏大”)。
【答案】90.9% 浓盐酸具有挥发性,会带来测量误差 吸收CO2气体中的水蒸气 偏大
【解析】
①样品质量为:574.57g-564.57g=10g,反应生成二氧化碳质量为:574.57g-570.57g=4g。
设:碳酸钙质量为x。
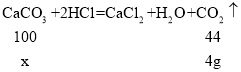
![]() x≈9.09g;该方案测得样品中CaCO3的质量分数=
x≈9.09g;该方案测得样品中CaCO3的质量分数=![]() ;
;
答:该方案测得样品中CaCO3的质量分数是90.9%。
②该实验中用稀HCl与CaCO3样品反应,而不用浓HCl与CaCO3样品反应,其原因是浓盐酸具有挥发性,会导致测量误差;
实验中无水氯化钙的作用是吸收二氧化碳气体中的水蒸气;若实验中不用无水氯化钙,则测得的二氧化碳质量偏大,从而导致样品中CaCO3的质量分数与上述实验计算结果相比偏大。

【题目】将足量碳酸钙加入到盛有50克稀盐酸的烧杯中,立即将烧杯放到天平上称量,在以后的8min内,每一分钟读一次数,结果如下表所示。
时间/min | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
质量/g | 92.0 | 91.0 | 90.5 | 90.1 | 89.8 | 90.0 | 89.8 | 89.8 | 89.8 |
(1)盛有反应物的烧杯质量减小的原因是:_____;
(2)表中有一个数据是不合理的,该结果的测得时间是第_____分钟;
(3)计算所用盐酸的质量分数(写出完整的计算过程)。_____
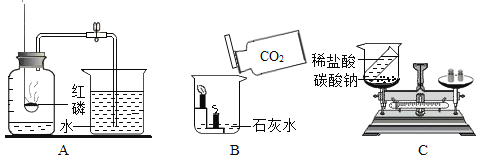
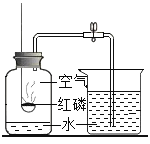
【题目】如图是某班进行的“空气中氧气含量测定”的分组实验.
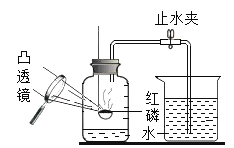
下面是某组凌乱的实验步骤记录:
①待集气瓶完全冷却至室温,打开止水夹;
②用凸透镜聚集阳光照射红磷;
③在集气瓶里加入适量的水,燃烧匙里放一小块红磷;
④红磷燃烧熄灭后,进行震荡;
⑤连接仪器,检查装置的气密性;
⑥计算出空气中氧气的体积分数.
(1)上述实验正确的步骤为__________________.(填写序号)
(2)红磷燃烧时,火焰呈黄色,同时产生浓厚的________.请写出红磷燃烧的文字表达式________。
(3)下表为该班的6个实验小组测定的数据:(集气瓶的容积为100mL,已扣除实验前加入的水量)
组别 | 1 | 2 | 3 | 4 | 5 | 6 |
进入集气瓶中水的体积/mL | 15 | 21 | 19 | 22 | 30 | 20 |
分析实验数据,从第2、3、4、6组验证出氧气约占空气体积的_____.(填百分比)
第1组出现较大偏差的原因可能是______________;
第5组出现较大偏差的原因可能是_____________
【题目】分类、类比是初中化学常用的学习方法。
(1)初中化学有许多实验,若按照实验方法分类,可将实验_____(填字母)分为一类;分类的依据是____________ 。
|
|
|
|
A 测定空气中氧气的含量 | B 探究可燃物燃烧 的条件 | C 探究反应前后物质的质量关系 | D 探究铁钉生锈的条件 |
(2)观察所给物质中氮元素化合价的排列规律,将合适的物质化学式填入空白处:N2 、N2O、____、N2O3、NO2。
(3)类比金属单质间的置换反应,某些非金属单质间也能发生置换反应,如 Cl2 比 Br2(溴)活泼,能与 HBr 发生反应:Cl2+2HBr=2HCl + Br2。已知 Cl2比 N2活泼,则 Cl2 与NH3 在一定条件下发生反应的化学方程式为____________________。