题目内容
【题目】为了测定鸡蛋壳中碳酸钙的质量分数,小张同学进行了如下实验探究.
(实验过程)
将鸡蛋壳洗净、干燥并捣碎后放入小烧杯里,加入足量的稀盐酸充分反应(假设其他杂质不与盐酸反应).测得相关数据如下所示:鸡蛋壳(12.5g)+ 稀盐酸(42.5g) → 至质量不减少剩余的混合物(50.6g)
(数据处理)
(1)根据质量守恒定律,反应生成二氧化碳的质量为_________g.
(2)请用化学方程式计算鸡蛋壳中碳酸钙质量是_________?并求此蛋壳中碳酸钙的质量分数是________?(写出计算过程)
【答案】4.4 10g 80%
【解析】
根据质量守恒定律可知,减少的质量就是生成的二氧化碳的质量,由二氧化碳质量可以计算碳酸钙的质量。
(1)根据质量守恒定律,反应生成二氧化碳的质量为12.5g+ 42.5g-50.6g=4.4g。
(2)设鸡蛋壳中碳酸钙质量是x。
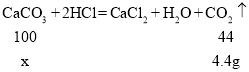
![]() ,x=10g,
,x=10g,
![]()
鸡蛋壳中碳酸钙质量是10g;碳酸钙的质量分数是80%。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
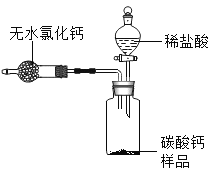
小学生10分钟应用题系列答案【题目】下列装置用于实验室中CO2的制备、净化、检验,最后收集一瓶干燥的CO2。请回答下列问题:
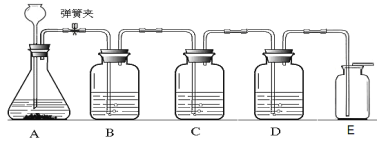
(1)对实验室制取二氧化碳药品选择的探究实验,记录如下:
组别 | 药品 | 实验现象 |
① | 碳酸钠粉末和稀盐酸 | 产生气泡速率很快 |
② | 块状石灰石和稀硫酸 | 产生气泡速率缓慢并逐渐停止 |
③ | 块状石灰石和稀盐酸 | 产生气泡速率适中 |
从制取和收集的角度分析,一般选择第____________(填序号)组药品,所发生反应的化学方程式为_______________________。
(2)C装置用于检验二氧化碳气体,则C中所盛放的物质是___________________,发生反应的化学方程式是_____________________。
(3)反应过程中将弹簧夹关闭,在A中观察到的现象是__________________________。
(4)E收集方法说明二氧化碳具有的物理性质是________________________________。