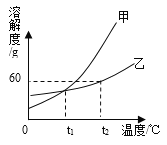
题目内容
【题目】人体代谢产生的过氧化氢,对人体有毒害作用。人体肝脏中的过氧化氢酶能催化过氧化氢分解产生氧气和水。某同学查阅资料发现,FeCl3也能催化过氧化氢分解。为比较过氧化氢酶和FeCl3催化效率的高低,该同学在28℃环境下进行了如下探究:
(1)提出问题:过氧化氢酶和FeCl3催化效率哪个更高?
(2)猜想与假设: 。
(3)实验材料:适宜浓度的FeCl3溶液,适宜浓度的新鲜猪肝研磨液(含有过氧化氢酶),适宜浓度的过氧化氢溶液等。
(4)实验步骤:
①取2支洁净的试管,编号为1、2,并各注入3mL适宜浓度的过氧化氢溶液;
②向1号试管内滴入2滴适宜浓度的FeCl3溶液,向2号试管内 ;
③观察并记录两支试管产生气泡的情况。
(5)预测实验结果:
请写出一种可能的实验结果: 。
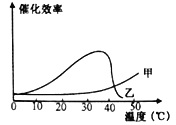
(6)在以上探究的基础上,该同学又完成了“探究温度对猪肝研磨液和FeCl3催化效率的影响”实验。实验结果如图所示。图中代表猪肝研磨液催化效率的曲线是 ,判断的理由是 。
【答案】(2)过氧化氢酶的催化效率更高(其他合理假设也可)
(4)②滴入2滴适宜浓度的新鲜猪肝研磨液
(5)1号试管产生气泡的速度比2号试管快(或“慢”或“基本相等”)
(6)乙 酶的活性受温度影响,在一定温度范围内,随着温度的升高,酶的活性增强超过最适温度后,随着温度的升高,酶的活性下降。
【解析】(2)由题意可知,是比较过氧化氢酶和FeCl3催化效率。任意一种假设均可。故填:过氧化氢酶的催化效率更高(其他合理假设也可);
(4)②进行对比实验,故向2号试管内滴入2滴适宜浓度的新鲜猪肝研磨液;
(5)根据实验的催化效果的快慢即可。可能的实验结果:1号试管产生气泡的速度比2号试管快(或“慢”或“基本相等”);
(6)由于酶的活性受温度影响,故选乙;判断的理由是酶的活性受温度影响,在一定温度范围内,随着温度的升高,酶的活性增强超过最适温度后,随着温度的升高,酶的活性下降。

 导学全程练创优训练系列答案
导学全程练创优训练系列答案【题目】某兴趣小组同学对NaOH、Na2CO3、NaHCO3、NaCl等常见的钠的化合物进行了研究。
【知识回顾】下列相关说法正确的是___。
A.NaCl主要存在于海水中
B.烧碱(NaOH)和纯碱(Na2CO3)都属于碱
C.Na2CO3和NaHCO3的俗名分别为苏打和小苏打
D.NaOH和Na2CO3都可用于治疗胃酸过多
【分析判断】电解饱和食盐水可制得“84”消毒液。你认为“84”消毒液的有效成分可能是__。
A.SO2 B. Na2CO3 C.KMnO4 D.NaClO
【提出问题】NaOH露置于空气中易变质,那么实验室中的氢氧化钠有没有变质呢?该小组同学对实验室中一瓶氢氧化钠固体样品的成分进行了探究。
【查阅资料】①NaOH在空气中不会转化成NaHCO3。
②BaCl2溶液呈中性,Ba(OH)2是可溶性碱。
③CO2在饱和的NaHCO3溶液中几乎不溶解。
【提出猜想】猜想Ⅰ:样品中只有NaOH
猜想Ⅱ:样品中只有Na2CO3
猜想Ⅲ:样品中既有NaOH又有Na2CO3
【实验探究】兴趣小组同学设计如下实验进行探究。
实验操作 | 实验现象与结论 |
1.取少量样品,加足量水。 | 样品全部溶解,得无色溶液。 |
2.取少量实验1所得无色溶液于试管中,滴加足量稀盐酸。 | 有气泡产生,则猜想_______(填“Ⅰ”、“Ⅱ”或“Ⅲ”)不成立。 |
3.取少量实验1所得无色溶液于试管中, 滴加足量BaCl2溶液。 | 有白色沉淀产生,有关化学方程式为_____________。 |
4.实验操作:__________________。 | 对应现象:______________,则猜想Ⅲ成立。 |
【定量研究】上述样品变质的程度如何呢?该兴趣小组同学设计如下图 装置测定样品中Na2CO3的质量分数。
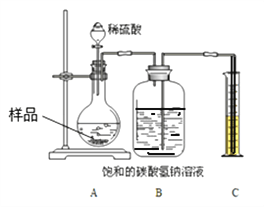
步骤如下:①按图连接好装置,并检查气密性;②准确称取该样品1.0g,放入烧瓶内;③打开分液漏斗活塞,滴加30.0%的稀硫酸至过量,关闭活塞;④反应结束后,量筒内液体的读数为55.0mL。(已知:室温条件下,CO2的密度为1.6gL﹣1)
(1)B装置集气瓶内原有的空气对实验结果_______________(填“有”或“没有”)影响。若用水代替饱和NaHCO3溶液,则所测CO2体积会偏小,原因是___________
(2)若将分液漏斗中的稀硫酸换成稀盐酸,则测试的结果可能______(填“偏大”、“偏小”或“不变”)。
(3)计算该样品中Na2CO3的质量分数((写出计算过程,结果保留到0.1%)__________。
【题目】某化学课堂上同学们进行酸、碱、盐知识的探究,请你参与其中并认真填写空格.
【学生实验】将二氧化碳分别通入石灰水和氢氧化钠溶液中,观察到前者变浑浊,后者无明显现象.
【学生板演】澄清石灰水变浑浊的原理________________(用化学方程式表示)。
【提出问题】二氧化碳通入氢氧化钠溶液中无明显现象,两者是否发生了化学反应?
【猜想假设】猜想①:两者发生了化学反应;猜想②:两者没有发生化学反应。
【实验探究】(1)小华设计了如图所示的A、B两个实验.
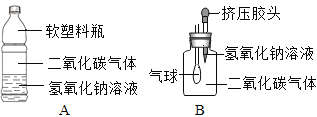
实验现象:A中软塑料瓶変瘪,B中___________。
(2)小红认为小华的实验是可行的,其共同原理是二氧化碳和氢氧化钠溶液反应,使容器内压强降低.小明同学却对此提出质疑,他认为小华的实验不严谨,其理由是___________,要得到科学严谨的结论,仍利用该装置,补做的对比实验是_______________。
(3)小宁设计的是通过检验生成物来验证猜想,请帮她填写实验报告。
实验步骤 | 实验现象 | 实验结论 |
向B实验后的溶液中加入 ______________ | __________________ | 证明了二氧化碳和氢氧化钠溶液反应 |
【实验结论】二氧化碳和氢氧化钠溶液反应
【反思拓展】通过此实验探究,我们发现,对于没有明显现象的化学反应,可以从两个不同的角度证明反应的发生,这两个角度是__________________。
【题目】某课外兴趣小组对一批铁样品(杂质不溶于水也不与稀硫酸反应)进行分析,甲、乙、丙三位同学分别进行实验,其中只有一位同学所取用的稀硫酸与铁样品恰好完全反应。实验数据如下表所示,请你认真分析数据,回答下列问题:
甲 | 乙 | 丙 | |
反应前,烧杯+稀硫酸 | 200g | 150g | 150g |
加入的铁样品质量 | 10g | 10g | 14g |
充分反应后,烧杯+剩余物 | 209.8g | 159.8g | 163.8g |
(1)同学所取用的稀硫酸与铁样品 恰好完全反应。
(2)计算样品中铁的质量分数。
(3)计算恰好完全反应后所的溶液中溶质的质量分数。(烧杯的质量为25 g,计算结果精确到0.1%)