��Ŀ����
����Ŀ��ij��ȤС��ͬѧ��NaOH��Na2CO3��NaHCO3��NaCl�ȳ������ƵĻ�����������о���
��֪ʶ�عˡ��������˵����ȷ����___��
����NaCl��Ҫ�����ں�ˮ��
�£��ռNaOH���ʹ��Na2CO3�������ڼ�
�ã�Na2CO3��NaHCO3�������ֱ�Ϊ�մ��С�մ�
�ģ�NaOH��Na2CO3������������θ�����
�������жϡ���ⱥ��ʳ��ˮ���Ƶá�84������Һ������Ϊ��84������Һ����Ч�ɷֿ�����__��
A��SO2 B�� Na2CO3 C��KMnO4 D��NaClO
��������⡿NaOH¶���ڿ������ױ��ʣ���ôʵ�����е�����������û�б����أ���С��ͬѧ��ʵ������һƿ�������ƹ�����Ʒ�ijɷֽ�����̽����
���������ϡ���NaOH�ڿ����в���ת����NaHCO3��
��BaCl2��Һ�����ԣ�Ba(OH)2�ǿ����Լ
��CO2�ڱ��͵�NaHCO3��Һ�м������ܽ⡣
��������롿�������Ʒ��ֻ��NaOH
�������Ʒ��ֻ��Na2CO3
�������Ʒ�м���NaOH����Na2CO3
��ʵ��̽������ȤС��ͬѧ�������ʵ�����̽����
ʵ����� | ʵ����������� |
1��ȡ������Ʒ��������ˮ�� | ��Ʒȫ���ܽ⣬����ɫ��Һ�� |
2��ȡ����ʵ��1������ɫ��Һ���Թ��У��μ�����ϡ���ᡣ | �����ݲ����������_______����������������� |
3��ȡ����ʵ��1������ɫ��Һ���Թ��У� �μ�����BaCl2��Һ�� | �а�ɫ�����������йػ�ѧ����ʽΪ_____________�� |
4.ʵ�������__________________�� | ��Ӧ����______________������������� |
�������о���������Ʒ���ʵij̶�����أ�����ȤС��ͬѧ�������ͼ װ�òⶨ��Ʒ��Na2CO3������������
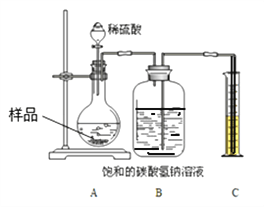
�������£��ٰ�ͼ���Ӻ�װ�ã�����������ԣ���ȷ��ȡ����Ʒ1.0g��������ƿ�ڣ��۴�Һ©���������μ�30.0%��ϡ�������������رջ������ܷ�Ӧ��������Ͳ��Һ��Ķ���Ϊ55.0mL������֪�����������£�CO2���ܶ�Ϊ1.6gL��1��
��1��Bװ�ü���ƿ��ԭ�еĿ�����ʵ����_______________����С���û�С���Ӱ�졣����ˮ���汥��NaHCO3��Һ��������CO2�����ƫС��ԭ����___________
��2��������Һ©���е�ϡ���ỻ��ϡ���ᣬ����ԵĽ������______���ƫ����ƫС�����䡱����
��3���������Ʒ��Na2CO3��������������д��������̣��������������������__________��
���𰸡� AC D �� Na2CO3+BaCl2=BaCO3��+2NaCl ȡ�ϲ���Һ���μӷ�̪��Һ���ⶨpH�� ��Һ���ɫ��pH��7������ֻҪ�������ɣ� û�� ������̼����ˮ ƫ�� 21.2%
����������֪ʶ�عˡ�A��NaCl��Ҫ�����ں�ˮ�У������е��Ȼ�����Ҫͨ����ˮɹ�εõ�������ȷ��
B���ռNaOH�����ڼ������Na2CO3�������Σ��ʴ���
C��Na2CO3��NaHCO3�������ֱ�Ϊ�մ��С�մ���ȷ��
D��NaOH����ǿ�ҵĸ�ʴ�ԣ�������������θ����࣬�ʴ���
�������жϡ����������غ㶨�ɣ���Ӧǰ��Ԫ�ص�����䣬����ʳ��ˮ��ֻ�����ơ��ȡ��⡢������Ԫ�أ�����������ֻ�������ơ��ȡ��⡢������Ԫ����ɣ���ѡD��
��ʵ��̽����ȡ����ʵ��1������ɫ��Һ���Թ��У��μ�����ϡ���ᣬ�����ݲ�����˵������̼���ƣ�����������
̼�������Ȼ�����Ӧ����̼�ᱵ���Ȼ��ƣ���ѧ����ʽΪ��Na2CO3+BaCl2=BaCO3��+2NaCl��
Ҫ��֤�������ƵĴ��ڣ�Ҫ�ȳ�ȥ̼���ƣ�����ȡ����ʵ��1������ɫ��Һ���Թ��У��μ�����BaCl2��Һ����ȡ�ϲ���Һ���μӷ�̪��Һ���ⶨpH�� �� ��Һ���ɫ��pH��7�������������
���������
��������������1��ԭ�п����ᱻ������̼����Bװ���У�����˶�����̼�����������Խ������Ӱ����������̼����ˮ��Ӧ��������ˮ�����Ա���NaHCO3��Һ�����ˮ���棬������CO2���ƫС��
��2�������������棬������лӷ��ԣ���ӷ����Ȼ������壬������Bװ����ʱ����̼�����Ʒ�Ӧ���ɶ�����̼��ʹ�����࣬��ʹ������Ʒ��Na2CO3�����������Ľ��ƫ����
��3����μӷ�Ӧ��̼������X��
Na2CO3+H2SO4=Na2SO4+H2O+CO2��
106 44
X 55.0mL��1.6g/L
![]()
x=0.212g
���Ը���Ʒ��Na2CO3����������Ϊ�� ![]() ��100%=21.2%��
��100%=21.2%��
�𣺸���Ʒ��Na2CO3����������Ϊ 21.2%��

����Ŀ��С����Э����ʦ����ʵ�鴢����ʱ������һƿ��Ŷ�����������ƣ�Ϊ����������������������̽����ȡ����������Ʒ11.4g����ƿ�У�����38.6gˮ��Ȼ����εμ�14.6%��ϡ���ᣬ����ϡ�������������ƿ�����ʵ�������ϵ���±���ʾ�����ʣ�
����ϡ���������/g | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
��ƿ�����ʵ�����/g | 60 | 70 | 80 | 90 | 100 | 109.12 | 118.24 | 128.24 |
��1���������Ʊ��ʵ�ԭ�������� ���û�ѧ����ʽ��ʾ����
��2�����������Ʒ�Ӧ��ϡ������Һ������Ϊ�� ��g��
��3������11.4g����Ʒ���������Ƶ�����������д��������̣������ȷ��0.1%����
��4�����ݼ����������ݻ�������CO2�����������ߡ�