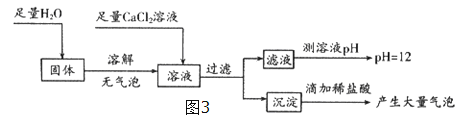
题目内容
【题目】有一包不纯的碳酸钠白色粉末,可能含有硫酸钠、氢氧化钠的一种或两种,某科学兴趣小组为探究其成分做了如下实验:
I、现取样品16g于烧杯中并加84g水搅拌,全部溶解。再向烧杯中逐渐滴加26.1%硝酸钡溶液并不断搅拌,烧杯内固体的质量随加入硝酸钡溶液的质量的变化关系如图甲所示。
II、在B点开始,向烧杯中滴加稀硝酸并不断搅拌,烧杯内固体的质量随加入稀硝酸的质量的变化关系如图乙所示。

(1)原白色固体中,除了Na2CO3外,一定还含有_____(填化学式),E点时,溶液中一定含有的溶质有_____种。
(2)计算:
①白色沉淀中碳酸钡的质量。
②D点时,溶液中硝酸钠的溶质质量分数。(计算结果精确到0.1%)
【答案】(1)NaOH和Na2SO4 ;3
(2)19.7g ; 8.6%
【解析】
(1)由图乙可知,BC段加入稀硝酸后沉淀的质量不减少,说明加入的稀硝酸与氢氧化钠反应生成了可溶性的硝酸钠和水,说明原溶液中含有氢氧化钠,CD段加入稀硝酸后沉淀的质量减少,说明与稀硝酸反应的沉淀是碳酸钡,DE段加入稀硝酸后沉淀不消失,说明沉淀不溶于稀硝酸,则这部分沉淀是硫酸钡,进而说明原溶液中含有硫酸钠,即原白色固体中,除了Na2CO3外,一定还含有氢氧化钠和硫酸钠,其化学式分别是NaOH和Na2SO4,故填NaOH和Na2SO4;
BC段的反应是氢氧化钠与稀硝酸反应生成硝酸钠和水,CD段的反应是碳酸钡与稀硝酸反应生成硝酸钡、水和二氧化碳,DE段加入的稀硝酸不再发生反应,所以E点时,溶液中一定含有的溶质有硝酸钠、硝酸钡和硝酸3种溶质,故填3。
(2)①由图可知,加入硝酸钡后生成的24.36g沉淀是碳酸钡与硫酸钡的质量和,由图乙可知,加入足量稀硝酸后剩余的4.66g沉淀是不溶于稀硝酸的硫酸钡,所以白色沉淀中碳酸钡的质量=24.36g4.66g=19.7g,故填19.7g。
②解:由题意可知,生成的沉淀中硫酸钡的质量是4.66g,碳酸钡的质量=24.36g4.66g=19.7g
设样品中碳酸钠的质量为m,与稀硝酸反应生成硝酸钠的质量为m1
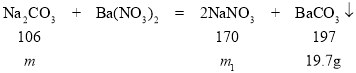
106:197= m:19.7g m=10.6g
170:197= m1:19.7g m1=17g
设样品中硫酸钠的质量为m2,与稀硝酸反应生成的硝酸钠的质量为m3
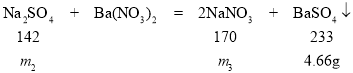
142:233= m2:4.66g m2=2.84g
170:233= m3:4.66g m3=3.4g
样品中氢氧化钠的质量=16g10.6g2.84g=2.56g
设硝酸钠与稀硝酸反应生成硝酸钠的质量为m4
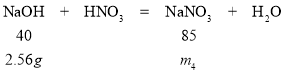
40:85=2.56g:m4 m4=5.44g
设碳酸钡与稀硝酸反应生成二氧化碳的质量为m5
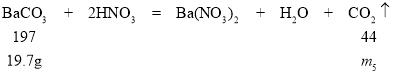
197:44=19.7g:m5 m5 =4.4g
D点时溶液中硝酸钠的质量=17g+3.4g+5.44g=25.84g
D点时溶液的质量=16g+84g+129.6g+80g4.66g4.4g=300.54g
D点时溶液中硝酸钠的质量分数=![]() ×100%≈8.6%
×100%≈8.6%
答:D点时溶液中硝酸钠的质量分数为8.6%。

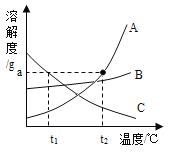
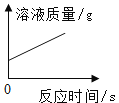
【题目】下表中,有关量的变化图像与其对应叙述相符的是( )
A | B | C | D |
|
|
|
|
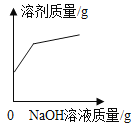
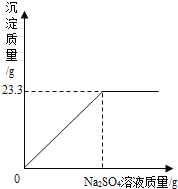
该图像可描述将一定量的水通直流电生成氢气质量随时间变化的情况 | t2℃时,相同质量的A、B饱和溶液中,A的饱和溶液中所含水的质量大于B的饱和溶液中所含水的质量 | 该图像可以描述石灰水 变质过程中溶液质量随时间变化的情况 | 向盛有HC1和CuCl2混合溶液的烧杯中逐滴加入NaOH溶液至过量 |
A.AB.BC.CD.D