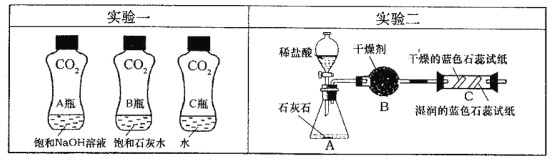
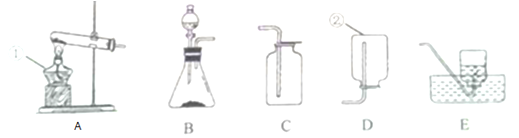题目内容
【题目】探究学习小组在实验室中用图1所示装置制取CO2并探究CO2与过氧化钠(Na2O2)的反应。
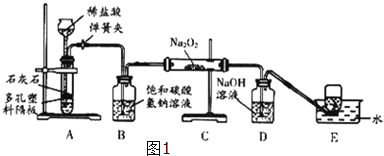
查阅资料得知:过氧化钠(Na2O2)是一种淡黄色固体,能与CO2,H2O发生反应: Na2O2+2CO2═2Na2CO3+O2,2Na2O2+H20═4NaOH+O2↑
请回答下列问题:
(1)装置A中发生反应的化学方程式为 ,利用装置A制取CO2的优点是 .
(2)装置B的作用是吸收CO2中混有的HCl,发生反应的化学方程式为 .
(3)装置D的作用是 .
(4)装置E中收集到的气体是 (填化学式),该气体还可以用下列图2装置中的 进行收集(填写字母序号).

(5)为探究反应后装置C硬质玻璃管中固体的成分,该小组同学进行了如图3实验:
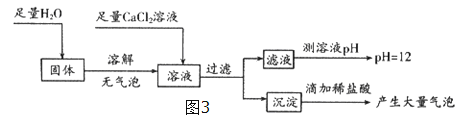
根据判断,反应后装置C硬质玻璃管中固体为 .
【答案】(1)CaCO3+2HCl=CaCl2+H2O+CO2↑,便于控制反应的发生和停止;
(2)NaHCO3+HCl=NaCl+H2O+CO2↑;
(3)除去二氧化碳气体;
(4)O2,ad;
(5)氢氧化钠和碳酸钠.
【解析】
试题分析:(1)装置A的作用是制取二氧化碳气体。其中碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑,装置A可以通过关闭止水夹使装置内压强增大;从而将固体和液体分离使反应停止。也可通过打开止水夹使装置内压强减小;从而将固体和液体接触而反应进行。所以利用装置A制取CO2的优点是:便于控制反应的发生和停止;
(2)碳酸氢钠可以和盐酸反应生成氯化钠、水和二氧化碳,从而达到除去氯化氢气体的目的。化学方程式为:NaHCO3+HCl=NaCl+H2O+CO2↑;
(3)氢氧化钠和二氧化碳反应生成碳酸钠和水,所以装置D的作用是除去二氧化碳气体;
(4)过氧化钠和二氧化碳、水反应会生成氧气,氢氧化钠可以将多余的二氧化碳除去,所以装置E中收集到的气体是O2。氧气密度比空气大,不易溶于水,密度比水小;可以用向上排空气法和排水法收集。所以可选择装置中的ad;
(5)根据图示可知:固体加水没有气泡,所以不含过氧化钠;加入氯化钙会生成白色沉淀,白色沉淀加盐酸,会生成气体,所以含有碳酸钠,反应后滤液的pH值是12,所以含有碱性物质氢氧化钠,所以反应后装置C硬质玻璃管中固体为氢氧化钠和碳酸钠.