题目内容
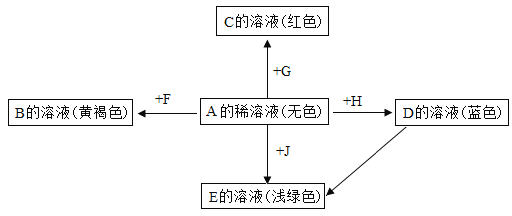
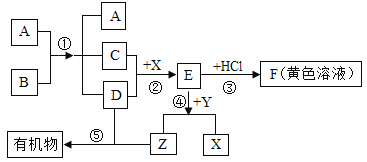
【题目】如图表示某些物质间转化关系(反应条件和部分产物已省略)。其中A、E为固体氧化物,且A为黑色粉末;B、D是由相同元素组成的无色液体,且B具有消毒杀菌作用;C、Y、Z为无色气体,其中Y有毒;X是最常见的金属。
请回答下列问题:
(1)反应①中A物起的是_____________作用;
(2)反应③在工业上有何用途__________________;
(3)在日常生活中为防止反应②的发生,可采取的措施是____________________(写一点即可)。
(4)反应④的化学方程式为_____________________。
【答案】催化 除铁锈 保持铁制品干燥或涂上一层保护膜 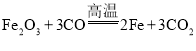
【解析】
A为固体氧化物,且A为黑色粉末,B、D是由相同元素组成的无色液体,且B具有消毒杀菌作用,由图可知,A与B反应后A仍存在,则A为二氧化锰,B为过氧化氢,C为氧气,D为水;E为固体氧化物,C(氧气)、D(水)和X反应生成E,E与盐酸反应得到黄色溶液,所以E为氧化铁,X为铁,则F为氯化铁;Y为无色气体,且Y有毒,能与E(氧化铁)反应生成X(铁)和气体Z,则Y为一氧化碳,Z为二氧化碳。
(1)由分析可知,A为二氧化锰,在过氧化氢分解制取氧气的反应中起催化作用,故填催化。
(2)由分析和图可知,反应③是氧化铁与盐酸反应生成氯化铁和水的过程,该反应在工业上可用来除铁锈,故填除铁锈。
(3)由图可知,反应②是铁锈蚀时发生的反应,为防止该反应的发生,采取的措施是保持铁制品干燥或涂上一层保护膜,故填保持铁制品干燥或涂上一层保护膜。
(4)由分析可知,反应④是氧化铁和一氧化碳在高温的条件下反应生成铁和二氧化碳的反应,故反应的化学方程式写为:Fe2O3+3CO![]() 2Fe+3CO2。
2Fe+3CO2。

 云南师大附小一线名师提优作业系列答案
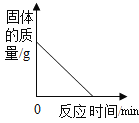
云南师大附小一线名师提优作业系列答案【题目】为测定硫酸铜与硫酸钠的混合溶液中溶质硫酸铜的质量分数,取该溶液100g,再将 120g一定质量分数的氢氧化钠溶液分6次加入到该溶液中,充分反应后,测得实验数据如下:
实验次数 | 1 | 2 | 3 | 4 | 5 | 6 |
加入氢氧化钠溶液质量/g | 20 | 20 | 20 | 20 | 20 | 20 |
生成沉淀物的质量/g | 1.96 | 3.92 | 5.88 | 7.84 | 9.8 | 9.8 |
(1)滴加氢氧化钠溶液的过程中的现象是: 。
(2)该混合溶液中溶质硫酸铜的质量分数是多少?
【题目】某兴趣小组的同学在实验室看到了一瓶久置的过氧化钠,发现它已变为白色粉末,同学们决定对该白色粉末的成分进行探究:
[提出问题]白色粉末含有哪些成分?
[查阅资料]①过氧化钠(Na2O2)为淡黄色粉末;②过氧化钠与水反应生成氢氧化钠和氧气,与二氧化碳反应生成碳酸钠和氧气;③碳酸钡、碳酸钙不溶于水。
[猜想与假设]
猜想一:白色粉末含有Na2O2和NaOH;
猜想二:白色粉末只有NaOH;
猜想三:白色粉末只有Na2CO3 ;
猜想四:白色粉末含有_________________。
[交流与讨论]
同学们认为猜想一不正确,原因是_________________;但小何同学认为仅靠视觉判断物质的组成不可靠,要通过实验来确认有无Na2O2。
[实验探究]小组同学设计了如下实验方案,请完成相关内容:
步骤 | 实验操作 | 实验现象 | 结论 |
① | 取少量样品于试管中,滴加适量的水 | ________ | 白色粉末不含有Na2O2 |
② | 取少量样品于试管中溶解,滴入足量的CaCl2溶液 | ________ | 白色粉末含有Na2CO3 |
③ | 取步骤②中反应后的上层清液,滴入________ | 溶液变红 | 白色粉末含有NaOH |
[实验结论]由上述实验可知猜想四成立,该粉末已全部变质。
[反思拓展]写出步骤②中发生反应的化学方程式:_________________。