��Ŀ����
����Ŀ����ͼ1��ʾΪʵ���ҳ��õ�ʵ��װ�ã�
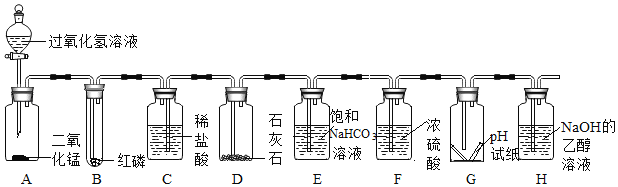
��1��д�������������ƣ�b_____��
��2��ʵ�����ø��������ȡ����ʱ��Ӧѡ��ķ���װ�ú��ռ�װ����_____����װ�õ���ĸ���ţ�����ѧ����ʽ_____��ʵ������ȡ������̼��ԭ����_____����ѧ����ʽ_____����Dװ���ռ�����ʱ������ʵ��������_____��
��3������Eװ���ռ�������������Ӧ��_____��ͨ�루��c��d����
��4��Fװ�ÿ������������ɵ�CO2������������ˮ���Ϸ�һ��ֲ���͵�Ŀ����_____��
��5��ij��ѧ��ȤС�����ʵ��ס��ң�װ����ͼ2��̽���������������ܷ�ʹ������ľ����ȼ��
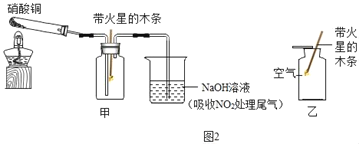
�����ϣ�������ͭ���ȷֽ���������ͭ������ɫ�����������壨�ж�����������
��ͬ��ͬѹ�£���ͬ��������֮�ȵ��ڷ��Ӹ���֮�ȡ�ʵ��������ͭ���ȷֽ�Ļ�ѧ����ʽΪ_____������ʵ������е�_____������ó���NO2��ʹ������ľ����ȼ���Ľ��ۡ�������������ɽǶȷ������ý�����ȷ��������_____��
���𰸡�����©�� AD 2KMnO4![]() K2MnO4+MnO2+O2�� ʯ��ʯ��ϡ���� CaCO3+2HCl�TCaCl2+H2O+CO2�� ����ƿ���д�����ð�� d ��ֹ������̼����ˮ����ˮ��Ӧ 2Cu��NO3��2
K2MnO4+MnO2+O2�� ʯ��ʯ��ϡ���� CaCO3+2HCl�TCaCl2+H2O+CO2�� ����ƿ���д�����ð�� d ��ֹ������̼����ˮ����ˮ��Ӧ 2Cu��NO3��2![]() 2CuO+4NO2��+O2�� ����ľ����ȼ������ľ������ȼ ����������������ͬ����Ϊ���֮һ
2CuO+4NO2��+O2�� ����ľ����ȼ������ľ������ȼ ����������������ͬ����Ϊ���֮һ
��������
��1������ѧ֪ʶ��֪����b�dz���©����
��2��ʵ�����ø��������ȡ����ʱ���ǹ�������ͷ�Ӧ��ѡ��Aװ��Ϊ����װ�ã��������ܶȴ��ڿ�������������ˮ�����ռ�װ��ʱD����Ӧѡ��ķ���װ�ú��ռ�װ����AD����ѧ����ʽΪ2KMnO4![]() K2MnO4+MnO2+O2����ʵ������ȡ������̼��ԭ����ʯ��ʯ��ϡ���ᣬ��ѧ����ʽCaCO3+2HCl�TCaCl2+H2O+CO2������Dװ���ռ�����ʱ��������ʵ������Ϊ����ƿ���д�����ð����
K2MnO4+MnO2+O2����ʵ������ȡ������̼��ԭ����ʯ��ʯ��ϡ���ᣬ��ѧ����ʽCaCO3+2HCl�TCaCl2+H2O+CO2������Dװ���ռ�����ʱ��������ʵ������Ϊ����ƿ���д�����ð����
��3������Eװ���ռ����������������ܶ�С�ڿ�����������Ӧ��d��ͨ�룻
��4��Fװ�ÿ������������ɵ�CO2������������ˮ���Ϸ�һ��ֲ������Ϊ�˷�ֹ������̼����ˮ��ˮ��Ӧ�����²ⶨ���ƫС��
��5��ʵ��������ͭ���ȷֽ⣬��ӦΪ��ʵ��������ͭ���ȷֽ���������ͭ�Ͷ�����������������ѧ����ʽΪ��2Cu��NO3��2![]() 2CuO+4NO2��+O2����
2CuO+4NO2��+O2����
�ɷ���ʽ��֪��������ĽǶȣ�ƿ�ڶ�������ռ���֮�ģ�����ռ���֮һ������������Ҳռ��������֮һ������ʵ������еļ���ľ����ȼ������ľ������ȼ����ó���NO2��ʹ������ľ����ȼ���Ľ��ۡ����������ɽǶȷ������ý�����ȷ�������ǣ�����������������ͬ����Ϊ��������֮һ��

 ��ͼͼ�麮����ҵ������ҵ���ִ�ѧ������ϵ�д�
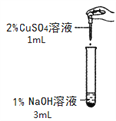
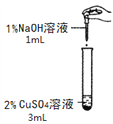
��ͼͼ�麮����ҵ������ҵ���ִ�ѧ������ϵ�д�����Ŀ����һ�λ�ѧʵ���У�����ͬѧ�����������ͭ��Һ������������Һ��Ӧ��ʵ�飬���۲쵽�˲�ͬ��ʵ������
��ʵ��һ��
ʵ���� | ���� | ���� |
ʵ����� |
|
|
ʵ������ | ������ɫ���� | ��������ɫ���� |
����֪��ɫ������������ͭ��д��������ɫ�����Ļ�ѧ����ʽ______��
��������⡿�������������ɫ�����ijɷ���ʲô�أ�
���������ϡ�
��ʽ����ͭ����ɫ���壬��ˮ���ܽ�ȼ�С��������ϡ����Һ��
��ʽ����ͭ����ɲ��̶���һ�����Cu2(OH)2SO4��ʾ��
����������衿����ɫ�����Ǽ�ʽ����ͭ��
��ʵ�����
ʵ�鲽�� | ��Ҫʵ����� | ������ |
�� | ȡ����ʵ���Ļ������� | �õ�����ɫ���� |
�� | ȡ����ɫ������������ˮϴ�Ӷ�� | ���������� |
�� | �����һ��ϴ��Һ�еμ�BaCl2��Һ | �������� |
�� | ȡϴ�Ӻ������ɫ�������Թ��У��μ�ϡ���� | ����ȫ���ܽ⣬�õ�����ɫ��Һ |
�� | ȡ��������ɫ��Һ���Թ��У��μ��Լ�X | ������ɫ���� |
ʵ����ۣ�����ɫ�����Ǽ�ʽ����ͭ | ||
����������ۡ�
�Ʋ���۵�ʵ��Ŀ����______��
�Dz�����е�ϡ����______��ѡ��ܡ����ܡ�����ϡ������档
�Ȳ�����еμӵ��Լ�X��______��
����˼�����ۡ�
�ɼ���ͬѧ�ڱ���ʵ��Ļ����Ͻ�һ��������ʵ�飺
�ٹ��ˣ�ȡ��ɫ�������Թ��У�
�ڵμ�______��������ɫ��Ϊ����ɫ��
���ظ�ʵ����еIJ���١��ݡ�
��ʵ����֤��������ͭҲ����ת��Ϊ��ʽ����ͭ���˷�Ӧ�Ļ�ѧ����ʽΪ______��
������ͬѧ��Ϊ���Լ���ԭ��ʵ��Ļ����ϣ������μ�______�����Խ���ʽ����ͭת��Ϊ������ͭ��ͨ��ʵ�飬Ҳ��֤�����ǵIJ��롣
��Ϊ��ȷ������������Һ������ͭ��Һ��Ӧ����������ͭ��ʵ��Ĺؼ���______��