题目内容
【题目】为测定一瓶久置的烧碱样品中氢氧化钠和碳酸钠的质量,取一定质量的该样品充分地溶解于水中,加入足量的氢氧化钙溶液至完全反应,生成10g碳酸钙沉淀。
(1)计算样品中碳酸钠的质量
(2)已知样品中钠元素的质量为27.6g,计算样品中氢氧化钠的质量
【答案】(1)10.6g
(2)40g
【解析】
(1)根据生成沉淀碳酸钙的质量,根据化学方程式进行计算。设样品中碳酸钠的质量为x,
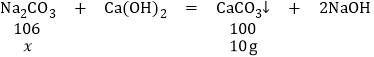
![]() x=10.6g
x=10.6g
(2)10.6g碳酸钠中含有钠元素的质量为:10.6g×![]() =4.6g,根据样品中钠元素的总质量可知氢氧化钠中含有的钠元素质量=样品中钠元素总质量-碳酸钠中含有的钠元素质量,再根据氢氧化钠中钠元素的质量分数进行计算,
=4.6g,根据样品中钠元素的总质量可知氢氧化钠中含有的钠元素质量=样品中钠元素总质量-碳酸钠中含有的钠元素质量,再根据氢氧化钠中钠元素的质量分数进行计算,
则氢氧化钠的质量为:(27.6g-4.6g)÷![]() =40g。
=40g。

 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案【题目】根据下列溶解度曲线和A物质的部分温度是的溶解度判断下列说法正确的是( )
温度/℃ | 0 | 20 | 40 | 60 | |
溶解度/g | A物质 | 20 | 28 | 45 | 60 |
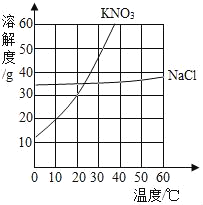
A. 由上图可知,KNO3和NaCl的溶解度均大于A 物质的溶解度
B. 10℃时,将40gNaCl放入50g水中,充分溶解,所得溶液是NaCl的不饱和溶液
C. 将30℃时NaCl、KNO3、和A物质的饱和溶液各降温至10℃,所得溶液的溶质质量分数大小为:KNO3>NaCl>A
D. 20℃时,将KNO3、NaCl和A物质各30g分别配制成恰好饱和溶液,所得溶液的质量大小为A>KNO3=NaCl
【题目】分析处理图表信息是学习的一种重要方法。如表是氯化钠、硝酸钾、氢氧化钙在不同温度下的溶解度。这三种固体物质的溶解度曲线如图所示。
温度/℃ | 20 | 40 | 60 | 80 | |
溶解度/g | NaCl | 36.0 | 36.6 | 37.3 | 38.4 |
KNO3 | 31.6 | 63.9 | 110 | 169 | |
Ca(OH)2 | 0.16 | 0.14 | 0.12 | 0.095 | |
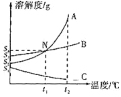
请仔细阅读图表后回答下列问题:
(1)A曲线表示的是_____的溶解度曲线。
(2)除去A中少量的B,步骤是:加水溶解,蒸发浓缩,_____,过滤,洗涤,干燥。
(3)20℃时,将氯化钠、硝酸钾、氢氧化钙各10g分别加入盛有50g水的烧杯中,充分溶解,测得三种溶液中溶质的质量分数分别为a%、b%、c%,则三者之间的大小关系是_____。
(4)现有一杯饱和溶液,是A、B、C三种饱和溶液中的一种,将其加热时出现浑浊现象,则这杯饱和溶液的溶质是_____。
【题目】某化学兴趣小组为了测定一批石灰石样品中碳酸钙的质量分数,取用4g石灰石样品,把40g稀盐酸(氯化氢的水溶液)分4次加入样品中(样品中除碳酸钙外,其余的成分既不与盐酸反应,也不溶解于水),充分反应后经过过滤、干燥等操作,最后称量,得实验数据如下:
次数 | 第1次 | 第2次 | 第3次 | 第4次 |
加入稀盐酸质量/g | 10 | 10 | 10 | 10 |
剩余固体的质量/g | 3.0 | 2.0 | 1.2 | m |
则求:⑴在第____次反应稀盐酸开始出现剩余,反应停止进行;上表格表m= ______g;
⑵求该石灰石样品中碳酸钙的质量分数为_______;
⑶实验室现要制取二氧化碳气体9.24克,需要上述这种纯度的石灰石质量为_____________?(要求有计算过程)