题目内容
【题目】某化学兴趣小组为了测定一批石灰石样品中碳酸钙的质量分数,取用4g石灰石样品,把40g稀盐酸(氯化氢的水溶液)分4次加入样品中(样品中除碳酸钙外,其余的成分既不与盐酸反应,也不溶解于水),充分反应后经过过滤、干燥等操作,最后称量,得实验数据如下:
次数 | 第1次 | 第2次 | 第3次 | 第4次 |
加入稀盐酸质量/g | 10 | 10 | 10 | 10 |
剩余固体的质量/g | 3.0 | 2.0 | 1.2 | m |
则求:⑴在第____次反应稀盐酸开始出现剩余,反应停止进行;上表格表m= ______g;
⑵求该石灰石样品中碳酸钙的质量分数为_______;
⑶实验室现要制取二氧化碳气体9.24克,需要上述这种纯度的石灰石质量为_____________?(要求有计算过程)
【答案】3 1.2g 70% 30g
【解析】
(1)比较第一、二、三次加入稀盐酸的数据可知,10g稀盐酸完全反应可消耗碳酸钙的质量为3.0g-2.0g=1g,第三次加入稀盐酸时消耗的碳酸钙的质量为2.0g-1.2g=0.8g,没有减少1g,说明此时碳酸钙已经反应完全,杂质为1.2g,稀盐酸出现剩余;所以第4次加入稀盐酸后,剩余固体的质量不变,即m=1.2g;
(2)样品中碳酸钙的质量分数为![]()
(3)解:设需要这样的石灰石的质量为x,则
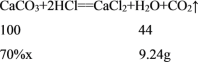
![]() ,得x=30g,
,得x=30g,
答:需要这样的碳酸钙30g。

练习册系列答案
相关题目