题目内容
【题目】(1)向含有 NaOH 和 Ca(OH)2 的混合溶液中缓缓通入 CO2直到过量。其现象为:开始出现沉淀,后来沉淀逐渐溶解。请按照先后顺序写出相应反应的化学方程式:
①_____________ ②_________
③![]() ④_________
④_________
(2)高氯酸(HClO4)是最强酸。现有一种不常见的氯的化合物叫做高氯酸氯,其分子中氯的质量分数为 0.526,且每个分子中含有 4 个氧原子。
①高氯酸氯的化学式为___________,物质类别可归为 __________。
②高氯酸氯在室温下即发生分解,形成 Cl2、O2和另一种氯的氧化物。已知该反应的化学方程式中3种产物的化学计量数相同。请写出该分解反应的化学方程式:___________。
(3)医药上可用石膏来固定骨折部位。石膏有熟石膏(CaSO4·![]() H2O,一种白色粉末)和生石膏(CaSO4·2H2O,一种坚硬的固体)两种,固定骨折的石膏是__________________。(填化学式)。固定时发生反应的化学方程式__________________。
H2O,一种白色粉末)和生石膏(CaSO4·2H2O,一种坚硬的固体)两种,固定骨折的石膏是__________________。(填化学式)。固定时发生反应的化学方程式__________________。
(4))CO与PdCl2溶液反应产生黑色金属钯粉末(反应中有水参加),用此来检测 CO 对环境的污染情况,此反应的化学方程式为:________,反应中中可能看到的现象是________。
【答案】![]()
![]()
![]() Cl2O4 氧化物
Cl2O4 氧化物 ![]() CaSO4·
CaSO4·![]() H2O
H2O ![]()
![]() 溶液中生成黑色沉淀
溶液中生成黑色沉淀
【解析】
(1)通入二氧化碳后,二氧化碳与氢氧化钙反应生成碳酸钙沉淀和水,二氧化碳与氢氧化钠反应生成碳酸钠和水,继续通入二氧化碳,二氧化碳与碳酸钠、水反应生成碳酸氢钠,二氧化碳与碳酸钙、水反应生成碳酸氢钙,碳酸氢钙溶于水,因此看到沉淀溶解,据此书写化学方程式;
故答案为:![]() ;
;![]() ;
;![]() 。
。
(2)①、设氯原子个数为n,则氯元素质量分数=![]() ,n=2,所以化学式为Cl2O4,由两种元素组成,且一种元素为氧元素,所以属于氧化物;
,n=2,所以化学式为Cl2O4,由两种元素组成,且一种元素为氧元素,所以属于氧化物;
故答案为:Cl2O4;氧化物。
②、反应为分解反应,所以反应物只有高氯酸氯,若只有1分子高氯酸氯参与反应,生成1分子氯气和1分子氧气,还剩余2个氧原子,无法形成含氯元素的氧化物,因此高氯酸氯最少有2分子参与反应,此时反应物有4个氯原子和8个氧原子,生成物为1分子氯气和1分子氧气,含有了2个氯原子和2个氧原子,还应有2个氯原子和6个氧原子,因此剩余氧化物化学式为Cl2O6,所以化学方程为高氯酸氯分解生成氯气、氧气和六氧二氯,书写化学方程式注意配平;
故答案为:![]() 。
。
(3)骨折时骨折部位需要固定,此时石膏应为粉末状,便于制成膏状物涂覆到受伤部位,然后再进行包扎固定,因此选用熟石膏,化学式为![]() ;熟石膏可以吸收水分变为生石膏,变为固体,达到固定受伤部位的目的,因此是熟石膏与水反应生成生石膏,书写化学方程式注意配平;
;熟石膏可以吸收水分变为生石膏,变为固体,达到固定受伤部位的目的,因此是熟石膏与水反应生成生石膏,书写化学方程式注意配平;
故答案为:![]() ;
;![]() 。
。
(4)反应物有一氧化碳、氯化钯和水,产物目前有钯,产物还应有氢元素、氯元素、碳元素和氧元素,氯化钯中钯元素显+2价,钯单质中钯元素为0价,化合价降低,所以还应出现一种元素化合价升高,在反应物中只有碳元素符合此条件,与氧元素结合生成二氧化碳,剩余氢元素与氯元素可以结合生成氯化氢,因此反应为一氧化碳、氯化钯和水反应生成钯、二氧化碳和氯化氢,据此书写化学方程式,注意配平;反应前为溶液,生成钯单质为黑色固体,因此可以看到溶液中有黑色沉淀生成;
故答案为:![]() ;溶液中生成黑色沉淀。
;溶液中生成黑色沉淀。

 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案【题目】某品牌可乐由水、白砂糖、焦糖色素(使可乐显黑褐色)、磷酸(H3PO4)等,按一定比例混合并压入二氧化碳配制而成。某同学为了探究可乐的成分及其含量,进行如下实验。
实验一 可乐中二氧化碳的定性检验
(1)请完成下表:
实验步骤 | 实验现象 | 结论 |
打开一塑料瓶装可乐,塞上带导管的橡胶塞,把导管插入 (填化学式)溶液中 | 观察到 | 可乐中含有二氧化碳 |
实验二 可乐中磷酸的定量测定
测定过程如下:
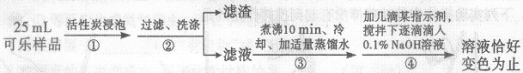
(2)步骤①用活性炭浸泡的目的是 。
(3)步骤③煮沸10分钟的目的是除尽滤液中的 。
(4)已知步骤④反应的化学方程式为H3PO4+NaOH=NaH2PO4+H2O,测得共消耗0.1%的NaOH溶液20g,忽略可乐中其它成分对测定结果的影响,计算可乐中磷酸的含量(以g/L为单位。相对分子质量:H3PO4—98;NaOH—40),写出计算过程。
(5)如果步骤②缺少洗涤,则测定结果 (填“偏高”“不变”或“偏低”)。