��Ŀ����
����Ŀ����ѧ��ȤС��̽������������ʱ����һ��ȥ������Ĥ��þ��������һ������ϡ�����У������ݲ�����д���������ݵĻ�ѧ����ʽ______��
��ַ�Ӧ���ã������Թ����лҰ�ɫ������
��������⡿
�Ұ�ɫ������ʲô���ʣ�
��������衿
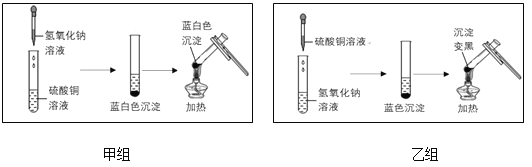
С����Ϊ�Ұ�ɫ����Ϊ̼��þ��MgCO3��������ͬѧ��Ϊ����Ҫʵ����ܷ�С���IJ��룬������_��
С����Ϊ���ڷ�Ӧ���Ȼ�þ��������ƫ�࣬�Ұ�ɫ����Ϊ�������ܽ���Ȼ�þ���塣
Сͮ��Ϊ�Ұ�ɫ����Ϊ�����þ��ϸ������
��ʵ��̽��1��
ʵ����� | ���� | ���� |
��ȡ�Թ��е��ϲ���Һ�������������Ȼ�þ���� | �Ȼ�þ��������ѡ�����ܽ����������ܽ����� | С�������� |
��ȡ������ɫ������������ϡ������ | ______��ѡ������������û����������ð�� | Сͮ������� |
��������̽���������ԭ�в������˷�
���������ϡ�
HCl+AgNO3�THNO3+AgCl����AgCl��һ�ְ�ɫ������
��ʵ��̽��2��
��������ȡ�Ұ�ɫ���������Թ��м��ȣ���պ����������Һ�IJ����������Թ��ڣ��������ϵ���Һ���ְ�ɫ���ǣ�֤��������______���塣�ٽ�ʪ���ʯ����Һ���ݹ�����ֽ�������Թܿڣ���ֽ��______ɫ��
ͬѧ�������ʦ���֪��������þ��ϡ���ᷴӦʱ����Һ�ᾭ�������Ե������Ҽ�������ǿ�Ĺ��̣��Ӷ������˼�ʽ�Ȼ�þ�������������ܣ���ʽ�Ȼ�þ�Ļ�ѧͨʽ�ɱ�ʾΪMgx��OH��yClz���䲻����ˮ�������ᷴӦ��
����˼��չ��
��1����þ��ϡ���ᷴӦ��ʵ��ʱ��þ�����������ٲ��˶ࡣ
��2����Ƭ��ͭƬ����ϡ�����в���������Ҳ����ͬ���ݴ��Ʋ�����Ļ�Ա�ͭ______�����ɸ�����������ͭ��Һ�ķ�Ӧ��ȷ�������ֽ����Ļ��ǿ�����÷�Ӧ�Ļ�ѧ����ʽΪ______��
(3)ȡһ�����ļ�ʽ�Ȼ�þ������Mgx��OH��yClz��������ϡ���ᣬ��������Һ�ֳ����ȷݡ�
����һ����Һ�еμӹ�����NaOH��Һ��������1.16gMg ( OH )2����;
������һ����Һ�еμӹ�����AgNO3��Һ��������1.435 g������
ͨ�������֪��x:z=_________�����ü�ʽ�Ȼ�þ�Ļ�ѧʽΪ_________��
���𰸡� ��ѧ����ʽ�� ��ѧ��Ӧǰ��Ԫ������ı䣬����Ӧ���в���̼Ԫ�� �ܽ� û�� HCl �� ǿ ��ѧ����ʽ�� 2:1 Mg2��OH��3Cl
����������һ��ȥ������Ĥ��þ��������һ������ϡ������,�������ݵĻ�ѧ����ʽ��Mg��2HCl��MgCl2 ��H2��. ��ַ�Ӧ���ã������Թ����лҰ�ɫ��������������⡿�Ұ�ɫ������ʲô���ʣ���������衿С����Ϊ�Ұ�ɫ����Ϊ̼��þ��MgCO3��������ͬѧ��Ϊ����Ҫʵ����ܷ�С���IJ��룬�����ǻ�ѧ��Ӧǰ��Ԫ������ı䣬����Ӧ���в���̼Ԫ�ء�С����Ϊ���ڷ�Ӧ���Ȼ�þ��������ƫ�࣬�Ұ�ɫ����Ϊ�������ܽ���Ȼ�þ���塣Сͮ��Ϊ�Ұ�ɫ����Ϊ�����þ��ϸ������
��ʵ��̽��1��
ʵ����� | ���� | ���� |
��ȡ�Թ��е��ϲ���Һ�������������Ȼ�þ���� | �Ȼ�þ�����ܽ� | С�������� |
��ȡ������ɫ������������ϡ������ | û������ð�� | Сͮ������� |
��������̽���������ԭ�в������˷����������ϡ�
HCl+AgNO3�THNO3+AgCl����AgCl��һ�ְ�ɫ��������ʵ��̽��2����������ȡ�Ұ�ɫ���������Թ��м��ȣ���պ����������Һ�IJ����������Թ��ڣ��������ϵ���Һ���ְ�ɫ���ǣ�֤��������HCl���塣�ٽ�ʪ���ʯ����Һ���ݹ�����ֽ�������Թܿڣ���ֽ���ɫ��������þ��ϡ���ᷴӦʱ����Һ�ᾭ�������Ե������Ҽ�������ǿ�Ĺ��̣��Ӷ������˼�ʽ�Ȼ�þ�������������ܣ���ʽ�Ȼ�þ�Ļ�ѧͨʽ�ɱ�ʾΪMgx��OH��yClz���䲻����ˮ�������ᷴӦ������˼��չ����1����þ��ϡ���ᷴӦ��ʵ��ʱ��þ�����������ٲ��˶ࡣ��2����Ƭ��ͭƬ����ϡ�����в���������Ҳ����ͬ���ݴ��Ʋ�����Ļ�Ա�ͭǿ�����ɸ�����������ͭ��Һ�ķ�Ӧ��ȷ�������ֽ����Ļ��ǿ�����÷�Ӧ�Ļ�ѧ����ʽΪFe��CuSO4��FeSO4��Cu��(3)ȡһ�����ļ�ʽ�Ȼ�þ������Mgx��OH��yClz��������ϡ���ᣬ��������Һ�ֳɡ�ͨ�������֪��x:z=![]() ��
��![]() ��2��1. ���������ܼ۴�����Ϊ��ԭ�����ü�ʽ�Ȼ�þ�Ļ�ѧʽΪ��Mg2��OH��3Cl��
��2��1. ���������ܼ۴�����Ϊ��ԭ�����ü�ʽ�Ȼ�þ�Ļ�ѧʽΪ��Mg2��OH��3Cl��
�㾦�ñ�����һ��ʵ��̽���⣬��Ҫ����ʵ��̽���Ļ���˼·�ͷ�����

 �ۺ��Բ�ϵ�д�
�ۺ��Բ�ϵ�д�