题目内容
【题目】M 是生活中常见的金属,MSO4 溶液是无色液体。某化学兴趣小组的同学欲探究 M 与铜、铝的活动性顺序,请你和他们一起进行以下探究活动。
(提出问题)M、铜、铝的金属活动性顺序是怎样的?
(猜想与假设)小敏的猜想是 Al>Cu>M;小强的猜想是 Al>M>Cu;你的猜想是 ______________。
(设计与实验一)小莉取 M 丝、铜丝、铝丝和编号为①、②、③的 3 支试管,进行如下表的实验(试管中均盛有体积相同、溶质质量分数也相同的稀盐酸):
实验操作 | M丝插入试管①中 | 铜丝插入试管②中 | 铝丝插入试管③中 | 实验结论 |
刚开始的现象 | 有少量气泡产生 | 无气泡 | 无气泡 | M>Cu;____ |
几分钟后的现象 | 有少量气泡产生 | 无气泡 | 有大量气泡产生 | _________ |
(设计与实验二)为了进一步探究三种金属的活动性顺序,同学们取粗细相同、打磨干净的 M 丝、铝丝及相关溶液,又进行了如图所示的实验:
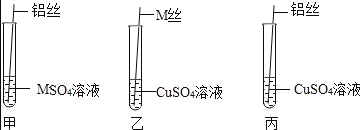
(1)试管乙中观察到的现象是____________ 。
(2)试管丙中反应的化学方程式为 ____________ 。
(交流与表达)同学们经讨论后认为该实验可以优化,去掉试管 ____________ (填试管编号)中的实验,也可以得出正确的结论。
(解释与结论)通过以上实验,同学们得出了三种金属的活动性顺序。
(评价与反思)实验结束后,同学们对实验过程进行了如下反思:
(1)影响金属与酸反应速率快慢的因素,除了相互反应的金属和酸的性质外,还有 ____________ (任写一种)。
(2)探究金属活动性顺序时,除了上述实验中已经用到的两种方法外,还可以根据 ____________ 进行判断(任写一种)。
【答案】M>Al>Cu M>Al Al>M>Cu M表面有红色固体析出,溶液蓝色消失 ![]() 丙 酸的浓度 金属与氧气反应的现象
丙 酸的浓度 金属与氧气反应的现象
【解析】
[猜想与假设]
小敏的猜想是 Al>Cu>M;小强的猜想是 Al>M>Cu;则还可以猜想M>Al>Cu。
[设计与实验一]
M 丝、铜丝、铝丝分别插入体积相同、溶质质量分数也相同的稀盐酸,刚开始时,M 丝有少量气泡,铜丝无气泡,铝丝无气泡,则可知M>Cu,M>Al;几分钟后,M 丝有少量气泡,铜丝无气泡,铝丝有大量气泡产生,则可知Al>M>Cu。
[设计与实验二]
为了进一步探究三种金属的活动性顺序,同学们取粗细相同、打磨干净的 M 丝、铝丝及相关溶液。
(1)试管乙中M插入硫酸铜溶液中,可观察到的现象是M表面有红色固体析出,溶液蓝色消失。
(2)试管丙中铝丝插入硫酸铜溶液中,反应的化学方程式为![]() 。
。
[交流与表达]
甲实验证明铝丝比M 丝活泼,乙实验证明M 丝比铜丝活泼,所以没有必要再做铝丝与硫酸铜溶液反应的实验,故可以去掉试管丙中的实验,也可以得出正确的结论。
[评价与反思]
实验结束后,同学们对实验过程进行了如下反思:
(1)影响金属与酸反应速率快慢的因素,除了相互反应的金属和酸的性质外,还有与酸的浓度有关。
(2)探究金属活动性顺序时,要利用金属的化学性质进行判断,第一个实验利用了金属与酸的反应,第二个实验利用了金属与盐溶液反应,还可以根据金属与氧气反应的现象进行判断。

 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案【题目】根据下表信息,相关说法正确的是
温度/°C | 20 | 30 | 40 | 60 | |
溶解度/g | KCl | 34.0 | 37.0 | 40 | 42.6 |
NaNO3 | 88.2 | 96.5 | 102.1 | 125.5 | |
A.NaNO3是易溶物质,KCl是可溶物质
B.40°C时,5gKCl加入10g水中可得浓度为33.3%的KCl溶液
C.除去NaNO3固体中的少量KCl,通常采用溶解降温结晶的方法
D.将60°C时NaNO3和KCl的饱和溶液分别降温至20°C,析出晶体较多的是NaNO3溶液
【题目】烧杯中盛有 x 溶液,逐滴加入(或通入)y 物质,烧杯内液体的 pH 变化如下图所示。则符合该变化的一组物质是
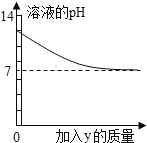
x | y | |
A | NaOH 溶液 | 稀 HCl(过量) |
B | 稀 H2SO4 | Mg(适量) |
C | Ca(OH)2 | CO2(适量) |
D | 稀 HCl | NaOH 溶液(过量) |
A.AB.BC.CD.D
【题目】人类的生活和生产都离不开金属,铁是世界产量最高且应用最广泛的金属。
(1)生活中用铁锅作炊具,是利用了铁的____性;
(2)铁制品生锈的主要条件是铁与____直接接触,铁锈的主要成分是____(填化学式);防止铁生锈的方法有____(答一种即可)。
(3)Pb的化合价有+2和+4价,Pb3O4属氧化物,也属于盐,其盐的化学式可表示为Pb2(PbO4),铁的氧化物Fe3O4也属于盐,则其盐的化学式可表示为____;
(4)取某钢样粉末50.0 g(假设只含Fe和C),在氧气流中充分反应,将产生的气体通入足量的澄清石灰水中,得到2.5 g白色沉淀。另取三份不同质量的该钢样粉末分别加入到100.0 g质量分数相同的稀H2SO4中,充分反应后,测得的实验数据如下表所示:
实验序号 | 甲 | 乙 | 丙 |
加入钢样粉末的质量(g) | 10.0 | 20.0 | 40.0 |
生成气体的质量(g) | 0.355 | 0.71 | 1.0 |
①根据表中数据可计算出稀硫酸中H2SO4的质量分数为____;
②若要使实验甲中的剩余硫酸全部消耗完,则至少需要再加入____g钢样粉末。