题目内容
【题目】取含有MgCl2和HC1的混合溶液165.8g于烧杯中,向其中缓慢加入200g溶质质量分数为8%的NaOH溶液,恰好完全反应后过滤得到沉淀和滤液,其中滤液的质量为360g。请计算:
(1)生成沉淀的质量是多少克。
(2)原混合溶液中,MgCl2的质量是多少?(请写出具体的计算过程,下同)
(3)恰好完全反应时,所得溶液的溶质质量分数是多少?(结果保留至0.1%)
【答案】(1)5.8g;(2)9.5g;(3)6.5%
【解析】
(1)根据质量守恒定律,化学反应前后,物质的总质量不变,故生成沉淀的质量是:165.8g+200g-360g=5.8g;
(2)设氯化镁的质量是x,消耗氢氧化钠的质量为y,生成氯化钠的质量为z
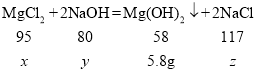
![]() x=9.5g
x=9.5g
![]() y=8g
y=8g
![]() z=11.7g
z=11.7g
(3)与稀盐酸反应的氢氧化钠的质量为:200g×8%-8g=8g
设稀盐酸与氢氧化钠反应生成氯化钠的质量为m
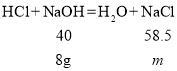
![]() m=11.7g
m=11.7g
恰好完全反应时,所得溶液的溶质质量分数是:![]() 。
。
答:(1)生成沉淀的质量是5.8克;
(2)原混合溶液中,MgCl2的质量是9.5g;
(3)恰好完全反应时,所得溶液的溶质质量分数是6.5%。

 小学课时特训系列答案
小学课时特训系列答案【题目】实验室可利用Zn与稀硫酸的反应制取H2。
(1)用浓硫酸配制稀硫酸的操作为________(填字母),用玻璃棒引流,并不断搅拌。
A 将浓硫酸缓缓注入盛有水的烧杯中
B 水缓缓注入盛有浓硫酸的烧杯中
(2)Zn与稀硫酸反应的化学方程式为___________。
(3)图-1所示的仪器B、D的名称为__________、________,组装制取H2的发生装置应选用的仪器为_________(填字母)。

(4)为收集并准确测量H2的体积,在装入药品前,需检查装置的_______。
(5)相同条件下H2密度比空气小,利用该性质可以通过_________法收集H2,若用图-2所示装置测量生成H2的体积,H2应从____________(填“甲”或“乙”)管通入。
(6)为探究影响Zn与稀硫酸反应快慢的因素,进行以下三组实验,室温下,取颗粒大小相同的锌粒与足量的稀硫酸反应,测量产生10mLH2(通常状况)所需的时间,下表为实验数据:
实验编号 | 硫酸的质量分数/% | 硫酸的体积/mL | 锌粒的质量/g | 时间/s |
1 | 10 | 10 | 1 | 78 |
2 | 10 | 10 | 2 | 57 |
3 | 40 | 10 | 1 | 9 |
①比较实验1、2的数据,可以得出的结论是________。
②由实验数据可知,该实验中对Zn与稀硫酸反应快慢影响较大的因素是________。
③比较不同条件下锌粒与稀硫酸反应的快慢有不同的方法,除测量产生相同体积的H2所需的时间,还可采用的测量方法是___________(写出一种)。