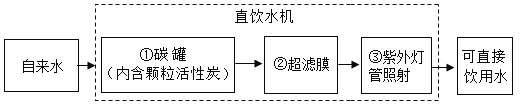
题目内容
【题目】回收利用废旧金属具有重要意义。某机械厂金属废料的成分是 Zn、Cu、ZnO和 CuO,某化学小组利用该金属废料回收铜并制取氧化锌和硫酸铜。请回答下列问题。
(活动一)回收铜并制取氧化锌,实验方案如下:

(1)步骤 I 所得滤液 a 中溶质的成分是____(填写化学式)。
(2)步骤 III 加入试剂甲的名称是______。
(3)步骤 IV 加入适量 NaOH 溶液的目的是________。
(活动二)利用活动一回收的铜制取硫酸铜,设计方案如下:
方案 A: ![]()
方案 B: ![]()
(信息)
(4)方案 A 中氧化铜与稀硫酸反应的化学方程式为____。
(5)小组同学从绿色化学的视角分析方案 B 不合理,理由是____(写出一条即可)。
【答案】ZnSO4、CuSO4、H2SO4 稀硫酸 使硫酸锌完全反应 ![]() 方案 B会生成二氧化硫,污染空气
方案 B会生成二氧化硫,污染空气
【解析】
锌和稀硫酸反应生成硫酸锌和氢气,氧化锌和稀硫酸反应生成硫酸锌和水,氧化铜和稀硫酸反应生成硫酸铜和水,硫酸锌和氢氧化钠反应生成氢氧化锌和硫酸钠。
(1)金属废料的成分是 Zn、Cu、ZnO和 CuO,加入过量稀硫酸,锌和稀硫酸反应生成硫酸锌和氢气,氧化锌和稀硫酸反应生成硫酸锌和水,氧化铜和稀硫酸反应生成硫酸铜和水,铜和稀硫酸不反应,步骤 I 是过滤,故所得滤液 a 中溶质的成分是硫酸锌、硫酸铜、过量的稀硫酸,化学式为ZnSO4、CuSO4、H2SO4。
(2)滤液a中溶质的成分是硫酸锌、硫酸铜、稀硫酸,步骤II加入过量的锌粉,锌和硫酸铜反应生成硫酸锌和铜,锌和稀硫酸反应生成硫酸锌和氢气,则滤渣中含有锌和铜,加入过量的试剂甲,过滤得到铜和滤液c,滤液b是硫酸锌,滤液c和滤液b均与氢氧化钠反应生成硫酸钠和氢氧化锌,则滤液c也是硫酸锌溶液,故步骤 III 加入试剂甲的名称是稀硫酸。
(3)硫酸锌和氢氧化钠反应生成氢氧化锌和硫酸钠,故步骤 IV 加入适量 NaOH 溶液的目的是使硫酸锌完全反应。
(4)方案 A 中氧化铜与稀硫酸反应生成硫酸铜和水,反应的化学方程式为![]() 。
。
(5)由质量守恒定律可知,反应前后元素的质量和种类均不变,浓硫酸中含有硫元素,生成物中含有二氧化硫,故小组同学从绿色化学的视角分析方案 B 不合理,理由是浓硫酸中含有硫元素,会生成二氧化硫,污染空气。

 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
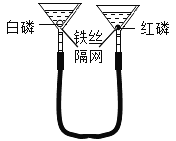
名师点睛字词句段篇系列答案【题目】验证可燃物燃烧的条件。已知:白磷、红磷的着火点分别是40℃、240℃。
装置(夹持仪器已略去) | 步骤及现象 |
| Ⅰ将一定量的白磷、红磷分別浸入80℃热水中(如左图所示)。白磷、红磷均不燃烧 Ⅱ.升高右侧漏斗至红磷露出水面。红磷不燃烧 Ⅲ.升高左侧漏斗至白磷露出水面。白磷燃烧 |
(1)Ⅰ中白磷不燃烧的原因是________。
(2)对比Ⅱ和Ⅲ,可验证可燃物燃烧的条件是______。