题目内容
【题目】实验室可利用Zn与稀硫酸的反应制取H2。
(1)用浓硫酸配制稀硫酸的操作为________(填字母),用玻璃棒引流,并不断搅拌。
A 将浓硫酸缓缓注入盛有水的烧杯中
B 水缓缓注入盛有浓硫酸的烧杯中
(2)Zn与稀硫酸反应的化学方程式为___________。
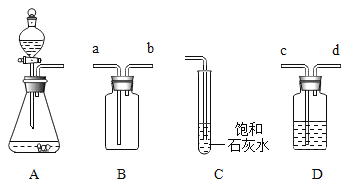
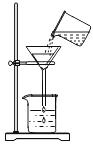
(3)图-1所示的仪器B、D的名称为__________、________,组装制取H2的发生装置应选用的仪器为_________(填字母)。

(4)为收集并准确测量H2的体积,在装入药品前,需检查装置的_______。
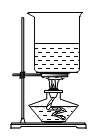
(5)相同条件下H2密度比空气小,利用该性质可以通过_________法收集H2,若用图-2所示装置测量生成H2的体积,H2应从____________(填“甲”或“乙”)管通入。
(6)为探究影响Zn与稀硫酸反应快慢的因素,进行以下三组实验,室温下,取颗粒大小相同的锌粒与足量的稀硫酸反应,测量产生10mLH2(通常状况)所需的时间,下表为实验数据:
实验编号 | 硫酸的质量分数/% | 硫酸的体积/mL | 锌粒的质量/g | 时间/s |
1 | 10 | 10 | 1 | 78 |
2 | 10 | 10 | 2 | 57 |
3 | 40 | 10 | 1 | 9 |
①比较实验1、2的数据,可以得出的结论是________。
②由实验数据可知,该实验中对Zn与稀硫酸反应快慢影响较大的因素是________。
③比较不同条件下锌粒与稀硫酸反应的快慢有不同的方法,除测量产生相同体积的H2所需的时间,还可采用的测量方法是___________(写出一种)。
【答案】A Zn+H2SO4=ZnSO4+ H2![]() 酒精灯 长颈漏斗 ACD 气密性 向下排空气 乙 在相同的条件下,锌粒的质量越大,反应生成相同体积的氢气越快 硫酸的质量分数 相同时间收集到氢气的体积
酒精灯 长颈漏斗 ACD 气密性 向下排空气 乙 在相同的条件下,锌粒的质量越大,反应生成相同体积的氢气越快 硫酸的质量分数 相同时间收集到氢气的体积
【解析】
(1)由于浓硫酸溶于水放出大量的热,因此用浓硫酸配制稀硫酸的操作为将浓硫酸缓缓注入盛有水的烧杯中,并用玻璃棒引流,并不断搅拌。故填:A。
(2)Zn与稀硫酸反应生成硫酸锌和氢气,其反应的化学方程式为:Zn+H2SO4=ZnSO4+ H2![]() 。故填:Zn+H2SO4=ZnSO4+ H2
。故填:Zn+H2SO4=ZnSO4+ H2![]() 。
。
(3)图-1所示的仪器B是酒精灯,常用的加热仪器;D是长颈漏斗,制取H2的发生装置为固液常温型,应选用的仪器有锥形瓶、双孔导管、长颈漏斗。故填:酒精灯;长颈漏斗;ACD。
(4)在制取气体的实验中,装入药品前,都需检查装置的气密性。故填:气密性。
(5)由于在相同条件下H2密度比空气小,利用该性质可以通过向下排空气法收集H2,若用图-2所示装置测量生成H2的体积,是通过测量排出的水来定的,因此H2应从乙管通入,使水从甲管排出到量筒中。故填:向下排空气;乙。
(6)①比较实验1、2的数据可知,变化量为锌粒的质量,比较时间可以得出的结论是在相同的条件下,锌粒的质量越大,反应生成相同体积的氢气所需的时间越短。故填:在相同的条件下,锌粒的质量越大,反应生成相同体积的氢气所需的时间越短。
②比较三组数据可知,当硫酸的质量分数变化时,反应生成相同体积的氢气所需的时间更短,因此该实验中对Zn与稀硫酸反应快慢影响较大的因素是硫酸的质量分数。故填:硫酸的质量分数。
③比较不同条件下锌粒与稀硫酸反应的快慢有不同的方法,除测量产生相同体积的H2所需的时间,还可采用相同时间收集到氢气的体积来测量。故填:相同时间收集到氢气的体积。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案