题目内容
【题目】水是大自然对人类的恩赐。
①水蒸发过程中,下列说法中正确的是__。(填写编号,下同)
a 水分子变大了 b 水分子间隔变大了 c 水分子在不断运动 d 水分子改变了
②水是良好的分散剂,根据图二所示甲、乙两种物质在水中的溶解度曲线,回答下列问题:
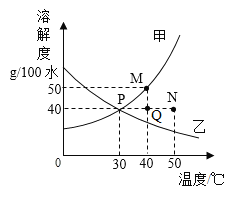
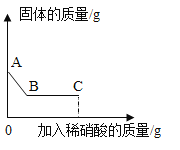
I. P点表示的含义是:___;
II.甲中混有少量乙时,提纯甲的最佳方法是__(填写编号);
a 蒸发结晶 b 恒温蒸发 c 降温结晶 d 用化学方法生成沉淀
Ⅲ.40°C时, 将30克甲放入50克水中,所得溶液的质量为__克;
IV.图中有关甲物质 M、N、P、Q 4种状态溶液的描述正确的是___。
a 都降低10°C,M、N溶质质量分数均减小
b 都恒温蒸发,M、N点均不动
c 都加入10g水,M、N点均不动
d 都升高10°C,M、N溶质质量分数均不变
e 40°C时,甲的饱和溶液中溶质质量分数为50%
f 升高10°C能使甲溶液的状态从P点转化为M点
【答案】bc 30°C时,甲和乙的溶解度相同都为40克 c 75 d
【解析】
①水蒸发过程中,水分子大小不变,水分子间隔变大了,水分子在不断运动,水分子种类没有改变。故选bc;
I. 根据溶解度曲线可知,P点表示的含义是30°C时,甲和乙的溶解度相同都为40克;
II 甲的溶解度受温度影响较大,随温度的升高而升高,乙的溶解度随温度的升高而降低,甲中混有少量乙时,提纯甲的最佳方法是降温结晶,故选c;
Ⅲ 40°C时, 甲的溶解度为50g,根据溶解度概念可知,100g水中最多溶解50g甲,即50g水中最多溶解25g,将30g甲放入50g水中,所得溶液的质量为50g+25g=75g;
IV a、都降低10℃,M点溶液有溶质析出,溶质质量分数减小,N点溶液仍没有达到饱和状态,没有溶质析出,溶质质量分数不变,故a错误;
b、都恒温蒸发,M点仍然40°C时饱和溶液,M点不动,N点溶液有达到饱和状态趋势,N点竖直向上运动,故b错误;
c、都加入10g水,N点均不动,M点由饱和溶液变成不饱和溶液,M点竖直向下移动,故c错误;
d、都升高10℃,M、N点都没有溶质析出,溶质质量分数均不变,故d正确
e、40°C时, 甲的溶解度为50g,甲的饱和溶液中溶质质量分数=![]() ,故e错误;
,故e错误;
f、升高10°C能使甲溶液的状态由饱和转化为不饱和,从P点转化为Q点,故f错误,故选d。

【题目】CO2 通入 NaOH 溶液中无明显现象,为探究 CO2 与 NaOH 溶液是否发生了反应,某兴 趣小组进行了如下探究:
(查阅文献)(1)20℃时,几种物质在水中的溶解度见下表:
物质 | Na2CO3 | NaHCO3 | Ca(OH)2 | Ba(OH)2 |
溶解度/g | 21.5 | 9.6 | 0.165 | 3.89 |
(2)本实验条件下,Na2CO3 溶液和 NaHCO3 溶液的 pH 分别约为 11.0 和 8.5。
(3)Na2CO3可以和二氧化碳、水反应生成碳酸氢钠。
(实验探究)
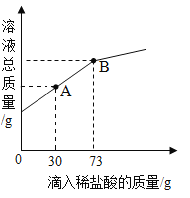
(1)实验一:小明用注射器抽取 20mLCO2,再抽取 5mLNaOH 溶液, 立即将针头插进橡皮塞中,振荡,发现注射器活塞左移,最后停在 10mL 刻度处,证明二氧化碳与氢氧化钠溶液发生了反应。小丽认为小明的结论不合理,又增加了一个实 验:_____(写出操作、现象),得出小明的结论正确。
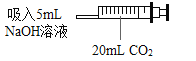
(2)实验二:小明又取实验一所得溶液少许于试管中,向其中滴加BaCl2溶液,观察到______(填 现象),证明 CO2 与 NaOH 溶液发生了反应。实验中不宜将 BaCl2 溶液换成 CaCl2 溶液的原因是____________________。
(3)实验三:小明继续向实验二的溶液中滴加 BaCl2溶液至过量,静置,取上层清液,滴入 2 滴 酚酞试液,发现溶液呈___ 色,证明溶液中有 NaOH 剩余。实验中,小明没有直接取实验一的溶液 滴入酚酞试液,理由是__________________________________。
(反思感悟)对于现象不明显的化学反应,可以通过______________________来证明反应的发生。
(4)实验四:兴趣小组同学用如图 1 装置将 CO2 持续通入一定浓度一定量的 NaOH 溶液中,用数 字化实验技术测定反应过程中溶液的 pH 变化,结果如图 2 所示。
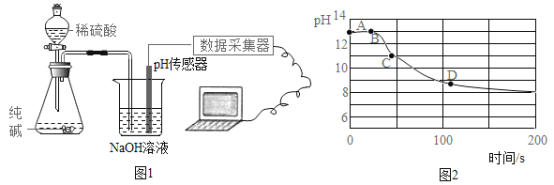
图 1 中,用纯碱与稀硫酸反应来制取二氧化碳,而不用大理石与盐酸反应来制取,理由是______________________________。最终溶液 pH 小于 8.5 的可能原因是__________________。CD 段发生反应的化学方程式为______________________________________。