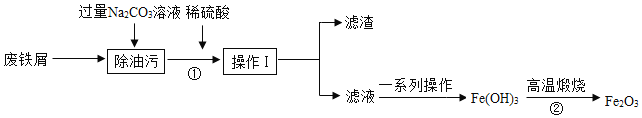
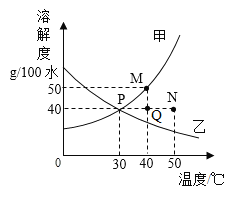
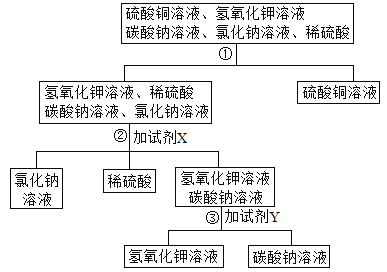
��Ŀ����
����Ŀ����ˮ���̲��ŷḻ����Դ����ˮ��ɹ�Ρ������пɵõ����κ�±ˮ�������г����ж������ʣ����������з�����ᴿ�������������������±ˮ����������ҵ��þ��ԭ�ϡ�
��1��ʵ���ҳ�ȥ�����в��������ʵIJ���Ϊ���ܽ⡢���ˡ������ᾧ���������ж�Ҫ�õ���һ�ֲ���������_____��
��2����Ҫ��ȥʳ�ι����к��е�����CaCl2���ʣ��õ���Ϊ������ʳ�ι��壮�����ʵ���������_____��
��3����һ�ձ���ʢ��Mg��OH��2��MgCl2�Ĺ����ĩ6g�������м���20gˮ��������ܽ������μ���������������Ϊ10%��ϡ���ᣮ�ձ������ʵ������������ϡ�����������ϵ��ͼ��ʾ����ش��������⣺
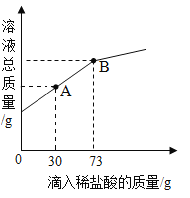
�ٵ�����ϡ����30gʱ����ͼ��A��ʱ�����ձ�����Һ�е�������_____����д��ѧʽ����
�ڵ�����ϡ����73gʱ����ͼ��B��ʱ������ͨ�����㣬����¶�ʱ���ò�������Һ�����ʵ�����_____����������ȷ��0.1g����
���𰸡������� ȡ��Ʒ���ձ��У���ˮ����ܽ⣬���ձ��м���������̼���ƣ������ˣ�����Һ�м���������ϡ���ᣬ�����ᾧ MgCl2 9.7g
��������
��1����Һ�����ˡ������ᾧ�����ж�Ҫ�õ���һ�ֲ��������Dz�������
��2���Ȼ�����̼���Ʒ�Ӧ����̼��Ƴ������Ȼ��ƣ����Կ��Ƚ������ܽ⣬���������̼������Һ�����˺�����Һ�м����������ᣬ������Ũ���ᾧ�õ��������Ȼ��ơ�
��3���ٵ�����ϡ����30gʱ����Ϸ�ĩ��Mg��OH��2��û�з�Ӧ���ձ���û�����ᣬ�����ձ�����Һ�е�������MgCl2��
�ڽ⣺���Ϸ�ĩ��Mg��OH��2������Ϊx����ϡ���ᷴӦ����MgCl2������Ϊy��
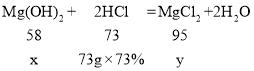
![]()
![]()
![]()
![]()
�����ò�������Һ�����ʵ�����Ϊ6g��5.8g+9.5g=9.7g��
�����ò�������Һ�����ʵ�����Ϊ9.7g��

 ����ϰ�⽭��ϵ�д�
����ϰ�⽭��ϵ�д� ѧ���쳵��������������������ϵ�д�
ѧ���쳵��������������������ϵ�д�