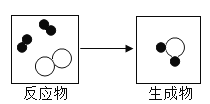
题目内容
【题目】乐乐同学取某地石灰石样品12g进行测定实验,现将100g稀盐酸分五次加入石灰石样品中(杂质不溶于水也不参与反应),充分反应后测得生成气体的总质量如表所示:
第1次 | 第2次 | 第3次 | 第4次 | 第5次 | |
加入稀盐酸的质量/g | 20 | 20 | 20 | 20 | 20 |
生成气体的总质量/g | 1.1 | 2.2 | m | 4.4 | 4.4 |
试求:
(1)CaCO3中钙与碳两种元素质量比_____。
(2)m的值为_____g。
(3)12g石灰石样品中碳酸钙的质量等于_____g。
(4)反应完全后最终溶液中氯化钙的质量分数?_____(写出计算过程,计算结果精确至0.1)
【答案】10:3 3.3 10 13.0%
【解析】
(1)CaCO3中钙与碳两种元素质量比是:40:12=10:3;
(2)根据记录数据可发现,20g的盐酸完全反应生成二氧化碳气体的质量是1.1g,第4次实验中加入盐酸生成的二氧化碳是4.4g,说明了第三次实验中盐酸完全反应,可推出m的值为3.3g;
(3)设石灰石中CaCO3的质量为x,生成的氯化钙的质量为y
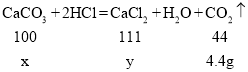
![]()
解得:x=10g y=11.1g
(4)最终溶液中氯化钙的质量分数是:![]() ≈13.0%。
≈13.0%。

【题目】化学实验不仅能提高同学们对化学学习的乐趣,更能提高动手能力。
(1)某化学小组用厨房里的物质进行以下实验,合理的是_____。
A 用食醋浸泡除去水壶里的水垢 B 用铁刷清洗铝锅上的油渍
C 用食盐水检验自来水的酸碱性 D 用打火机检验煤气是否泄漏
(2)该小组在社会实践活动中,考察了某工厂的废水(无色)处理流程,并取该厂未经处理的废水样品进行测定
①用紫色石蕊溶液检验废水的酸碱性,石蕊溶液呈红色,于是该兴趣小组确定该废水中一定含有_____(填离子符号)
②另取该废水少量,滴加适量Ba(NO3)2溶液,有白色沉淀产生,说明该废水中一定含有的酸根离子是_____。
③活动后小组同学推测该厂废水处理时可以加入_____,使废水达到中性后再排放。
(3)已知该工厂废水中除含有以上离子外,还含有Mg2+,该兴趣小组继续进行探究,验证废水中含有Mg2+,进行了如下实验:
实验步骤 | 实验现象 | 实验结论 |
取少量废液于试管中,向试管中逐滴滴加NaOH溶液 | 刚开始试管中_____;一会儿可以看到试管中_____。 | 废液中含有Mg2+ |
写出有关反应的化学方程式_____(写一个即可)。
(4)乙炔(C2H2)是一种重要的化工原料。常用碳化钙(CaC2)与水反应制取乙炔,同时产生氢氧化钙。若要制取1.3g乙炔气体,理论上需要碳化钙的质量是多少_____?