题目内容
【题目】乙醇在常温常压下是一种易燃、易挥发的无色透明液体。现将 4.6gC2H5OH 与一定量的氧气置于密闭容器中,通过电火花点火,乙醇完全反应,容器内具体数值见下表。根据表格提供的数据, 下列说法错误的是
C2H5OH | O2 | CO2 | M | H2O | |
反应前质量(g) | 4.6 | a | 0 | 0 | 0 |
反应后质量(g) | 0 | 0 | 4.4 | b | c |
A.c 的数值为 5.4
B.M 中一定有碳元素
C.当 a≧9.6 时,产物中将不会有 M
D.当 a 的值在合理范围内发生变化时,b、c 的值也随之变化
【答案】D
【解析】
A、反应前后氢元素的质量不变,则有:4.6g×![]() =c×
=c×![]() ,c=5.4g,故A选项说法正确;
,c=5.4g,故A选项说法正确;
B、反应前后碳元素的质量不变,酒精中含有碳元素质量为:4.6g×![]() =2.4g,生成的二氧化碳中含有碳元素质量为:4.4g×
=2.4g,生成的二氧化碳中含有碳元素质量为:4.4g×![]() =1.2g,故M中含有1.2g碳元素,故B选项说法正确;
=1.2g,故M中含有1.2g碳元素,故B选项说法正确;
C、酒精完全燃烧需要氧气的质量:

故当a≥9.6时,产物中将不会有M,故C选项说法正确;
D、当a的值在合理范围内发生变化时,c的值不变,故D选项说法错误。
故选D。

【题目】甲、乙、丙是初中化学常见物质。这些物质之间的转化关系如下图所示。
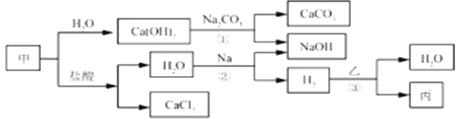
根据以上信息,请回答下列问题。
(1)写出甲的化学式__________。
(2)写出反应①的化学方程式_______________。
(3)写出反应②的化学方程式_______________。该反应属于_____反应(填基本反应类型)。
(4)反应③在一定温度下进行,若乙为Fe2O3,则丙为Fe;若丙为Cu,则乙为_______(填化学式)。
(5)请完成下列表格,证明Fe的金属活动性比Cu的强。
实验方案 | 实验现象 |
将铁片浸入_______(填化学式)溶液中 | 铁片表明析出______固体 |
【题目】化学小组对酸具有的相似性质很感兴趣,欲对硝酸的性质进行实验探究。
(实验设计)(1)将石蕊试液滴入稀硝酸中,预计石蕊试液由紫色变__色。
(2)将Zn片投入稀硝酸中,预计将产生H2.
(实验验证)同学们按上述设计做了实验,却发现石蕊变色后一会儿即褪去,Zn片投入稀HNO3后,溶液中冒出气泡,产生无色气体A,在试管口A变成红棕色有刺激性气味的气体B.
(提出问题)(1)石蕊试液变色后为何会褪色?
(2)上述产生的无色气体是什么? 硝酸具有哪些特性?
(查阅资料)看到如此异常的现象,在老师的指导下,同学们上网查到了下列资料:
(1)硝酸可与Zn、Cu等多种金属反应生成相应的硝酸盐,但不生成H2 .
(2)含氮元素的某些气态物质的物理性质如下表:
NH3 | N2 | NO | NO2 | |
顏色 | 无色 | 无色 | 无色 | 红棕色 |
溶解性 | 极易溶于水 | 不溶于水 | 不溶于水 | 可溶于水或硝酸 |
(猜想与分析)
(1)小明同学认为石蕊变色后又褪色的原因是由于试管不干净,含有其他杂质造成的,要证明小明的观点,应进行的操作是______.
(2)大家一致认同了红棕色气体B是NO2,但对于无色气体A及其变化的原因有不同的看法:
①小丽同学认为A是NH3,但大家一致反对,原因是_________;
②小强同学认为A是N2,大家也一致反对,理由是__________;
③最后大家获得了A是NO的共识。因为NO在试管口遇氧气生成NO2,该反应方程式为___
(实验探究)“硝酸能否与Cu反应”?小红很感兴趣,便取了一小块铜片投入稀HNO3中,发现Cu溶解,也出现上述Zn与稀HNO3反应的类似现象,确证生成了NO,测出恰好反应的Cu和HNO3的质量比为8:21,由此获得了Cu与稀HNO3的反应方程式为______________.
(交流与反思)稀HCl跟铜不反应是因为铜的金属活动性比氢__(填“弱”或“强”),而稀HNO3却能和铜反应是因为稀HNO3具有强的氧化性,能与Cu发生氧化还原反应,生成NO等物质。
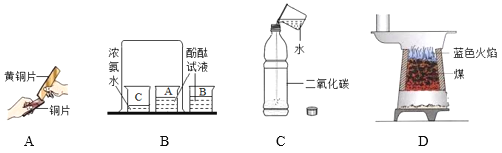
【题目】下列实验设计能达到目的的是
选项 | A | B | C | D |
实验设计 |
|
|
|
|
实验目的 | 证明二氧化碳与水反应生成碳酸 | 证明二氧化碳不可燃、不助燃、密度大于空气 | 证明铁铜银的活动性顺序 | 证明可燃物燃烧需要氧气和温度达到着火点 |
A.AB.BC.CD.D