题目内容
【题目】甲、乙、丙是初中化学常见物质。这些物质之间的转化关系如下图所示。
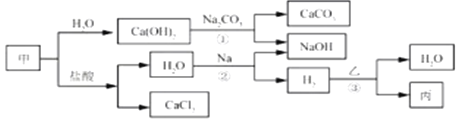
根据以上信息,请回答下列问题。
(1)写出甲的化学式__________。
(2)写出反应①的化学方程式_______________。
(3)写出反应②的化学方程式_______________。该反应属于_____反应(填基本反应类型)。
(4)反应③在一定温度下进行,若乙为Fe2O3,则丙为Fe;若丙为Cu,则乙为_______(填化学式)。
(5)请完成下列表格,证明Fe的金属活动性比Cu的强。
实验方案 | 实验现象 |
将铁片浸入_______(填化学式)溶液中 | 铁片表明析出______固体 |
【答案】(1)CaO;(2)Ca(OH)2+Na2CO3=CaCO3↓+2NaOH;
(3)2Na+2H2O=2NaOH+H2↑;置换;(4)CuO;(5)CuSO4(或CuCl2);红色。
【解析】(1)根据转化关系,甲能与水反应生成氢氧化钙,还能与盐酸反应生成氯化钙和水,故甲是氧化钙,氧化钙表示为CaO;(2)氢氧化钙和碳酸钠反应生成碳酸钙沉淀和氢氧化钠,反应的化学方程式表示为Ca(OH)2+Na2CO3=CaCO3↓+2NaOH;(3)根据转化关系,钠与水反应生成氢氧化钠和氢气,反应的化学方程式表示为2Na+2H2O=2NaOH+H2↑,该反应的反应物是一种单质和一种化合物,生成物也是一种单质和一种化合物,属置换反应;(4)在加热的条件下,氢气还原氧化铜生成铜和水,即乙是氧化铜,氧化铜表示为CuO;(5)根据金属活动性顺序的应用:位于前面的金属能把位于后面的金属从化合物的溶液中置换出来,故要证明铁的活动性比铜强,可将铁片浸入到硫酸铜溶液中,观察到铁片的表面出现一层红色的固体,说明铁的活动性比铜强。

练习册系列答案
相关题目