题目内容
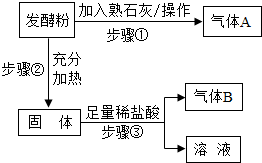
某不纯的碳酸钠固体,可能含有碳酸钙、氯化钙、硫酸铜、氢氧化钠、氯化钠中的一种或几种,实验小组同学对该碳酸钠固体中杂质成分进行探究.
【实验1】

(1)根据实验1的现象对下列物质作出判断(请将空格补充完整):
(2)甲同学根据实验1判断样品中一定含有氢氧化钠,他的理由是 ;乙同学不同意甲的说法,乙同学的理由是 .
(3)为进一步探究样品成分,同学们又利用实验1所得无色澄清液体继续实验.
【实验2】

实验2是为了检验 的存在,为达到此目的,其中所用氯化钡溶液也可以换为 溶液.
【实验1】

(1)根据实验1的现象对下列物质作出判断(请将空格补充完整):
| 物质 | 判断 | 判断依据 |
| 氯化钠 | 不能判断 |  |
| 碳酸钙 | 一定不含 | 碳酸钙不溶于水 |
| 硫酸铜 | |  |
| 氯化钙 | |
(3)为进一步探究样品成分,同学们又利用实验1所得无色澄清液体继续实验.
【实验2】

实验2是为了检验
考点:实验探究物质的组成成分以及含量,碱的化学性质,盐的化学性质,书写化学方程式、文字表达式、电离方程式
专题:科学探究
分析:(1)根据硫酸铜溶于水形成蓝色溶液以及氯化钙能和碳酸钠反应生成碳酸钙沉淀进行解答;
(2)根据氢氧化钠固体溶于水放热以及碳酸钠溶于水时也放热进行解答;
(3)根据氯化钡溶液和碳酸钠反应生成碳酸钡沉淀和氯化钠,氢氧化钠溶于水呈碱性,能使酚酞试液变红进行解答.
(2)根据氢氧化钠固体溶于水放热以及碳酸钠溶于水时也放热进行解答;
(3)根据氯化钡溶液和碳酸钠反应生成碳酸钡沉淀和氯化钠,氢氧化钠溶于水呈碱性,能使酚酞试液变红进行解答.
解答:解:(1)硫酸铜溶于水形成蓝色溶液,氯化钙能和碳酸钠反应生成碳酸钙沉淀和氯化钠,而样品溶于水能得到无色澄清的液体,说明一定没有硫酸铜和氯化钙,其中化学方程式为Na2CO3+CaCl2═CaCO3↓+2NaCl;故填:一定不含;一定不含;Na2CO3+CaCl2═CaCO3↓+2NaCl;
(2)氢氧化钠固体溶于水放热,所以判断样品中一定含有氢氧化钠;但是碳酸钠溶于水时也放热,所以乙同学不同意甲的说法;故填:氢氧化钠溶于水放热;碳酸钠溶于水时也放热;
(3)氯化钡溶液和碳酸钠反应生成碳酸钡沉淀和氯化钠,氢氧化钠溶于水呈碱性,能使酚酞试液变红,所以实验2是为了检验氢氧化钠的存在,氯化钙溶液也能和碳酸钠反应生成碳酸钙沉淀进而氯化钠,所以为达到此目的,其中所用氯化钡溶液也可以换为氯化钙溶液.故填:氢氧化钠;CaCl2.
(2)氢氧化钠固体溶于水放热,所以判断样品中一定含有氢氧化钠;但是碳酸钠溶于水时也放热,所以乙同学不同意甲的说法;故填:氢氧化钠溶于水放热;碳酸钠溶于水时也放热;
(3)氯化钡溶液和碳酸钠反应生成碳酸钡沉淀和氯化钠,氢氧化钠溶于水呈碱性,能使酚酞试液变红,所以实验2是为了检验氢氧化钠的存在,氯化钙溶液也能和碳酸钠反应生成碳酸钙沉淀进而氯化钠,所以为达到此目的,其中所用氯化钡溶液也可以换为氯化钙溶液.故填:氢氧化钠;CaCl2.
点评:根据物质的性质或变化规律,结合实验探究中每步实验所出现的现象,对混合物的可能组成进行分析、判断,最终形成结论.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
恰当的安全措施能减少生命财产的损失,下列处理措施错误的是( )
| A、油锅着火,立即盖上锅盖 |
| B、进入久封的地窖时,先检验CO2的浓度 |
| C、煤气泄漏,立即打开排气扇 |
| D、点燃氢气前,先检验气体的纯度 |
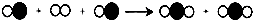
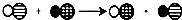
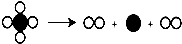
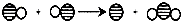
 某品牌氮肥商标如图所示,为确定其含氮量是否合格,进行了如下实验:取氮肥20g,加入足量NaOH固体,混合均匀后加热,发生反应生成(NaNO3)、氨气和水,待充分反应后收集到干燥的氨气3.4g.请通过计算判断该氮肥是否达标(杂质不参与反应,杂质中不含氮元素)
某品牌氮肥商标如图所示,为确定其含氮量是否合格,进行了如下实验:取氮肥20g,加入足量NaOH固体,混合均匀后加热,发生反应生成(NaNO3)、氨气和水,待充分反应后收集到干燥的氨气3.4g.请通过计算判断该氮肥是否达标(杂质不参与反应,杂质中不含氮元素) 某兴趣小组为了验证质量守恒定律,在两个小试管中分别注入20g溶质质量分数为20%的氢氧化钠溶液和20g硫酸铜溶液溶液,放于一个大烧杯中称量,如图5所示,然后将两只小试管内药品倒入烧杯中(试管不取出),恰好完全反应,试根据要求,回答下列问题:
某兴趣小组为了验证质量守恒定律,在两个小试管中分别注入20g溶质质量分数为20%的氢氧化钠溶液和20g硫酸铜溶液溶液,放于一个大烧杯中称量,如图5所示,然后将两只小试管内药品倒入烧杯中(试管不取出),恰好完全反应,试根据要求,回答下列问题: