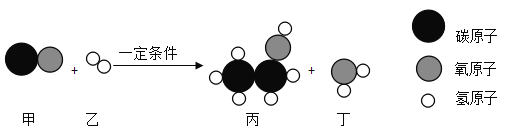
题目内容
【题目】金属材料是日常生活中应用广泛的材料。
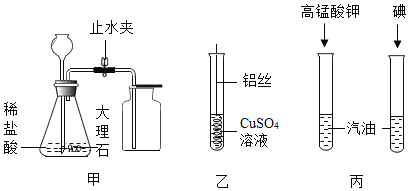
(1)金属铝比铁活泼,但铝制品更耐腐蚀的原因是_________________。
(2)某化学小组在![]() 、
、![]() 和
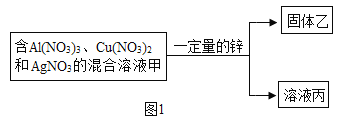
和![]() 的混合溶液甲中加入一定量的锌粉,充分反应后过滤,得到固体乙和溶液丙。且溶液甲和溶液丙的质量相等。
的混合溶液甲中加入一定量的锌粉,充分反应后过滤,得到固体乙和溶液丙。且溶液甲和溶液丙的质量相等。
①写出一个有关反应的化学方程式_________。
②向固体乙上滴加盐酸____________(选填“一定有”“可能有”或“一定没有”)气泡产生。
③写出溶液丙中一定含有的金属离子_________(写化学符号)。
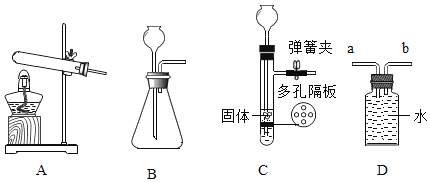
(3)利用下图装置可以纯净、干燥的CO还原![]() 并检验气体产物。已知收一氧化碳发生装置得到的CO中混有杂质
并检验气体产物。已知收一氧化碳发生装置得到的CO中混有杂质![]() 和
和![]() 。
。
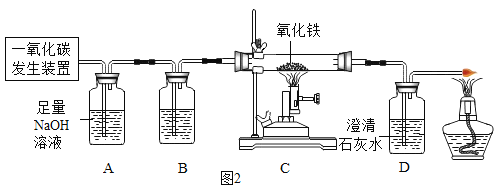
①装置B中应盛放的试剂是____________。
②装置C玻璃管里可观察到什么现象_________?
③实验中装置E的作用是什么_________?
④如果冶炼200t含杂质20%的生铁,需要含氧化铁80%的赤铁矿石的质量是多少_________?
【答案】铝与氧气反应生成一层致密的氧化铝薄膜,阻止铝进一步被氧化 ![]() [或
[或![]() ] 可能有
] 可能有 ![]() 浓硫酸 固体粉末由红棕色逐渐变黑。 点燃尾气一氧化碳,防止其污染空气 350t
浓硫酸 固体粉末由红棕色逐渐变黑。 点燃尾气一氧化碳,防止其污染空气 350t
【解析】
解:(1)铝和空气中的氧气反应生成致密的氧化铝薄膜,阻碍铝的进一步反应,所以金属铝比铁活泼,但铝制品更耐腐蚀;
(2)排在前面的金属可以将排在后面的金属从其盐溶液中置换出来,在Al(NO2)3、Cu(NO3)2和AgNO3的混合溶液中加入锌粉,锌会先与硝酸银反应,再与硝酸铜反应,充分反应后过滤,锌和硝酸银反应,溶液质量减少,锌和硝酸铜反应,溶液质量增加,溶液甲和溶液丙的质量相等,所以锌和硝酸银、硝酸铜都发生了化学反应,所以:
①锌和硝酸铜反应生成硝酸锌和铜,化学方程式为:Cu(NO3)2+Zn=Zn(NO3)2+Cu;
②加入的锌可能是过量的,所以向固体乙上滴加盐酸可能有气泡产生;
③溶液丙中一定含有的金属离子有Al3+、Zn2+;
(4)①浓硫酸具有吸水性,所以装置B中应盛放的试剂是浓硫酸;
②一氧化碳和氧化铁在高温的条件下生成铁和二氧化碳,所以装置C玻璃管里可观察到的现象是:红棕色粉末逐渐变成黑色;
③一氧化碳有毒,需要尾气处理,所以实验中装置E的作用是:处理尾气;
④设需要含氧化铁80%的赤铁矿石的质量是x,
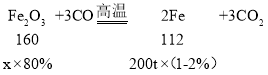
![]()
x=350t。

 考前必练系列答案
考前必练系列答案【题目】已知氯化钾、硝酸钾在不同温度时的溶解度如下
温度/℃ | 0 | 20 | 40 | 60 | |
溶解度/g | 氯化钾 | 27.6 | 34.0 | 40.0 | 45.5 |
硝酸钾 | 13.3 | 31.6 | 63.9 | 110.0 | |
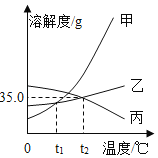
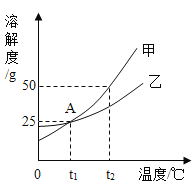
依据上表数据和溶解度曲线判断,下列说法错误的是( )
A.能表示硝酸钾和氯化钾的溶解度曲线分别是甲和乙
B.t1℃时,氯化钾和硝酸钾的溶解度相等,在34.0g至35.0g之间
C.t2℃时,用甲、乙配制等质量的饱和溶液,甲所需要水的质量比乙少
D.将t1℃时甲、乙、丙三种物质的饱和溶液升温到t2℃,其溶液中溶质质量分数的大小关系为甲>乙=丙
【题目】实验室有一小瓶实验课后剩余的固体![]() ,其中可能混有少量
,其中可能混有少量![]() 、
、![]() 、
、![]() 、
、![]() 中的一种或两种杂质。为了不浪费药品,实验小组在老师的指导下进行了如下实验。下图为同学们可能进行过的一些操作
中的一种或两种杂质。为了不浪费药品,实验小组在老师的指导下进行了如下实验。下图为同学们可能进行过的一些操作
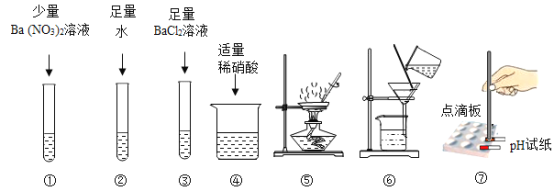
(实验一)取少量固体于试管中,依次进行以下实验确定杂质的成分
步骤 | 上图实验编号 | 实验现象 |
1 | ____________ | 得到无色澄清溶液 |
2 | ③、④ | 开始有白色沉淀,后来不再产生白色沉淀 |
3 | ①或_______ | (略) |
实验结论:![]() 固体中只有
固体中只有![]() 和
和![]() 两种杂质。
两种杂质。
(实验二)除去杂质,得到![]() 溶液作为氮肥施用到校园的花园里。
溶液作为氮肥施用到校园的花园里。
同学们经过讨论认为实验过程中加入的稀硝酸必须足够但不宜过多,为更好地控制稀硝酸的用量,应采用以下具体操作:
把瓶内固体全部倒入烧杯中,加足量水使固体全部溶解,先进行上图实验__________(填编号),再进行上图实验④至____________________________________________________(填现象)。