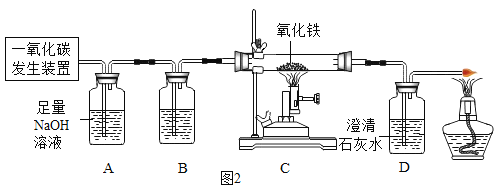
题目内容
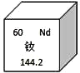
【题目】已知氯化钾、硝酸钾在不同温度时的溶解度如下
温度/℃ | 0 | 20 | 40 | 60 | |
溶解度/g | 氯化钾 | 27.6 | 34.0 | 40.0 | 45.5 |
硝酸钾 | 13.3 | 31.6 | 63.9 | 110.0 | |
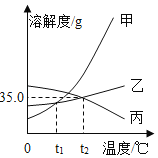
依据上表数据和溶解度曲线判断,下列说法错误的是( )
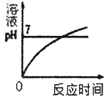
A.能表示硝酸钾和氯化钾的溶解度曲线分别是甲和乙
B.t1℃时,氯化钾和硝酸钾的溶解度相等,在34.0g至35.0g之间
C.t2℃时,用甲、乙配制等质量的饱和溶液,甲所需要水的质量比乙少
D.将t1℃时甲、乙、丙三种物质的饱和溶液升温到t2℃,其溶液中溶质质量分数的大小关系为甲>乙=丙
【答案】D
【解析】
A、由表中的数据及溶解度曲线的意义可知,氯化钾、硝酸钾两种固体物质的溶解度都是随温度升高而增大,甲的溶解度随温度的变化大,所以能表示硝酸钾和氯化钾的溶解度曲线分别是甲和乙,选项说法正确;故不符合题意;
B、由溶解度随温度变化的情况可知,t1℃时,氯化钾和硝酸钾的溶解度相等,在34.0g至35.0g之间,选项说法正确;故不符合题意;
C、t2℃时,甲的溶解度大于乙,用甲、乙配制等质量的饱和溶液,甲所需要水的质量比乙少,选项说法正确;故不符合题意;
D、将t1℃时甲、乙、丙三种物质的饱和溶液升温到t2℃,甲、乙的溶液变为不饱和溶液,溶质的质量分数不变,丙有晶体析出成为t2℃的饱和溶液,由于在t2℃时丙的溶解度大于在t1℃甲、乙的溶解度,所以其溶液中溶质质量分数的大小关系为:丙>乙=甲,选项说法错误;故符合题意;
故选D

【题目】有三位同学在研究碱的性质时发现氢氧化钠、氢氧化钙等可溶性碱都能使酚酞溶液变红。他们想进一步探究:不溶性的氢氧化镁是否也能使酚酞溶液变红。为此,他们将适量的氢氧化镁加入到盛有热水的烧杯中搅拌,然后向浑浊的液体中滴加酚酞溶液,发现酚酞溶液变红,可是过一会儿红色又消失了。
(提出问题)上述酚酞溶液变红、红色又消失的原因是什么?
(作出猜想)小王:可能是浑浊液中的固体氢氧化镁使酚酞溶液变红,氢氧化镁沉降后溶液就变无色。
小胡:可能是酚酞溶液与空气中的氧气反应,使红色消失;也可能是氢氧化镁溶液与空气中的一氧化碳反应的缘故。
小翠:可能是在热水中氢氧化镁的溶解度大,溶液中![]() 离子较多,使酚酞溶液变红;过一会儿温度降低,氢氧化镁的溶解度减小,溶液中
离子较多,使酚酞溶液变红;过一会儿温度降低,氢氧化镁的溶解度减小,溶液中![]() 离子变少,酚酞溶液又变无色。
离子变少,酚酞溶液又变无色。
(讨论交流)小翠认为小王的猜想不正确,从碱使酚酞试液变色的原因上给出解释:_____。
(实验验证)(1)三位同学讨论后认为要验证小胡的猜想,还需做如下实验,你知道其实验的目的吗?
实验步骤 | 设计目的 |
将氢氧化镁加入到热水中搅拌,滴入酚酞溶液,并在上方滴一些植物油 | _____ |
(2)小翠设计了如下对比实验方案证明自己的猜想,请将其方案补充完整。
实验方法 | 可能观察到的现象 | 结论 |
取两支试管,分别加入等质量的 | _____ | 红色消失与氢氧化镁的溶解度随温度降低而减小有关 |
(拓展延伸)在生活和生产中对氢氧化镁还有一些了解。
(1)热水瓶用久后,瓶胆内壁常附着一层水垢(主要成分是碳酸钙和氢氧化镁),可以用稀盐酸来洗涤,写出其与氢氧化镁反应的方程式_____。
(2)胃酸(主要成分是盐酸)过多,会引起很多胃病,氢氧化镁和碳酸氢钠都是抗胃酸药剂的主要成分,如果服用等量(指主要成分)的这两种药,服用![]() 的药效比服用
的药效比服用![]() “强”的原因是:_____。
“强”的原因是:_____。
(3)氢氧化镁在温度达到380℃时,能够分解生成耐高温的氧化镁固体和水蒸气,此分解过程中吸收大量的热。将它添加在塑料等易燃性建筑材料中能起阻燃作用,所以氢氧化镁是一种新型的阻燃剂。根据灭火原理你认为氢氧化镁能做阻燃剂的原因是_____(填序号)。
A 氢氧化镁是一种碱 B 受热分解的产物能使可燃物与氧气隔绝 C 氢氧化镁不溶于水
D 使可燃物的温度降到着火点以下 E可以降低可燃性建筑材料的着火点
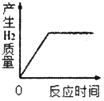
【题目】课外活动小组的同学利用锌粉进行实验,他们称取6.5g锌粉样品于烧杯中,并将30g稀硫酸平均分成三次加入烧杯中,实验数据见表
实验序号 | 加入稀硫酸的质量/g | 反应后烧杯中剩余物质的质量/g |
第一次 | 10 | 16.4 |
第二次 | 10 | 26.3 |
第三次 | 10 | 36.3 |
请计算
(1)产生气体的总质量为_____g
(2)恰好完全反应时烧杯中所得溶液中溶质的质量分数。_____(精确到0.1%)