题目内容
将适量的下列物质,分别投入等质量、等溶质质量分数的稀盐酸中,恰好完全反应后,产生的气体全部逸出,所得溶液中的MgCl2的质量分数最大的是
| A.Mg | B.MgO | C.Mg(OH)2 | D.MgCO3 |
A
根据化学方程式
Mg+2HCl=MgCl2+H2↑ MgO+2HCl=MgCl2+H2O Mg(OH)2+2HCl=MgCl2+2H2O
24 73 95 2 40 73 95 18 58 73 95 36
MgCO3+2HCl=MgCl2+H2O+CO2↑
84 73 95 18
它们含镁元素质量相等,因此它们与盐酸生成氯化镁中含镁元素的质量相等,由化学式可知它们生成氯化镁的质量也相等,根据化学方程式不难看出四个反应中生成的氯化镁的质量是相等的,即所得溶液中溶质的质量相等;而所得溶液中溶剂除了原稀盐酸溶液中的溶剂之外,氧化镁、氢氧化镁、碳酸镁和稀盐酸反应分别生成18克、36克、18克水,因此所得溶液中溶质的质量分数由大到小的顺序是Mg> MgO=MgCO3>Mg(OH)2.故选A
Mg+2HCl=MgCl2+H2↑ MgO+2HCl=MgCl2+H2O Mg(OH)2+2HCl=MgCl2+2H2O
24 73 95 2 40 73 95 18 58 73 95 36
MgCO3+2HCl=MgCl2+H2O+CO2↑
84 73 95 18
它们含镁元素质量相等,因此它们与盐酸生成氯化镁中含镁元素的质量相等,由化学式可知它们生成氯化镁的质量也相等,根据化学方程式不难看出四个反应中生成的氯化镁的质量是相等的,即所得溶液中溶质的质量相等;而所得溶液中溶剂除了原稀盐酸溶液中的溶剂之外,氧化镁、氢氧化镁、碳酸镁和稀盐酸反应分别生成18克、36克、18克水,因此所得溶液中溶质的质量分数由大到小的顺序是Mg> MgO=MgCO3>Mg(OH)2.故选A

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
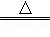 CaCO3↓+CO2↑+H2O,得到沉淀1.0g.回答下列问题:
CaCO3↓+CO2↑+H2O,得到沉淀1.0g.回答下列问题: