题目内容
(7分)工业上以黄铁矿(主要成分FeS2,杂质不含硫元素)为原料生产硫酸。其反应原理为:①FeS2与O2高温下反应生成SO2;②SO2在催化剂作用下与O2反应生成SO3;③SO3与H2O反应生成H2SO4。试回答以下问题:
⑴生产中的尾气未经处理,排放到空气中会引起的环境问题是 。
⑵FeS2中硫元素的质量分数为 。
⑶若1.00 t SO2与O2的混合气体中,含SO2 0.40 t。在一定条件下反应,有80%的SO2发生转化,则反应后SO3的质量是 ,反应后混合气体中SO3的质量分数是 。
⑷若上述SO3与H2O完全反应,可生产98%浓硫酸多少吨?(计算过程写在答题卡上)
⑴生产中的尾气未经处理,排放到空气中会引起的环境问题是 。
⑵FeS2中硫元素的质量分数为 。
⑶若1.00 t SO2与O2的混合气体中,含SO2 0.40 t。在一定条件下反应,有80%的SO2发生转化,则反应后SO3的质量是 ,反应后混合气体中SO3的质量分数是 。
⑷若上述SO3与H2O完全反应,可生产98%浓硫酸多少吨?(计算过程写在答题卡上)
⑴引起酸雨(1分) ⑵8/15或53.33%(1分) ⑶0.4 t(1分) 40%(1分) (4)0.5t
根据化学式计算FeS2中硫元素的质量分数,
由题意可知SO2的质量,根据化学方程式列比例求得反应后SO3的质量,反应后混合气体中SO3的质量分数
根据SO3的质量,求得硫酸的质量
⑷设可生产98%的浓硫酸的质量为x
SO3 + H2O= H2SO4
80 98
0.4 t x×98%
x= ="0.5" t
="0.5" t
答:可生产98%的浓硫酸的质量0.5 t。
由题意可知SO2的质量,根据化学方程式列比例求得反应后SO3的质量,反应后混合气体中SO3的质量分数
根据SO3的质量,求得硫酸的质量
⑷设可生产98%的浓硫酸的质量为x
SO3 + H2O= H2SO4
80 98
0.4 t x×98%
x=
 ="0.5" t
="0.5" t 答:可生产98%的浓硫酸的质量0.5 t。

练习册系列答案
相关题目

 CaO + CO2 ↑。
CaO + CO2 ↑。
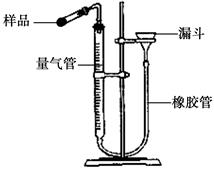
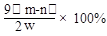 。此方案测定结果偏小的原因可能是 。
。此方案测定结果偏小的原因可能是 。