��Ŀ����
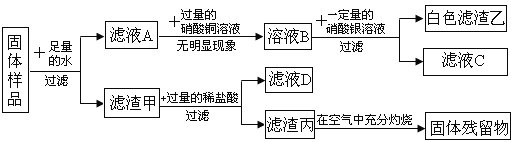
����Ŀ��һ�����庬��þ�ۡ�̼�ۡ�����ͭ���������ơ��Ȼ����е�һ�ֻ��֡�Ϊ̽���������ɣ�ij��ѧ��ȤС�������������ʾʵ�飺
��ش��������⣺
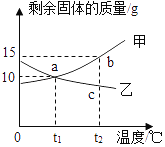
��1��ʵ�������ɰ�ɫ�����ҵĻ�ѧ����ʽΪ___________��
��2��ԭ������һ��û�е�������______��д���ƻ�ѧʽ���ɣ���ͬ����ԭ����_____________
��3����������һ�����е�������____________��
��4��ʵ���������ȤС�齫��ҺC����ҺD�����뵽��Һ�ף��а�ɫ�������ɣ����ú������ϲ���ҺE�в��������ӣ���E��һ�����е�������________
���𰸡�KCl+AgNO3=AgCl��+KNO3 �������� ��ҺA�м������������ͭ��Һ������������ ����ͭ��þ KNO3��HNO3��Cu��NO3��2��Mg��NO3��2
��������
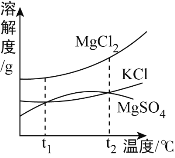
����ͭ��þ�ۡ�̼�۶�������ˮ���������ơ��Ȼ���������ˮ��������Ʒ��������ˮ���ˣ���ҺA�п��ܴ����������ơ��Ȼ��أ��������������ͭ�����������������ƺ�����ͭ������������ͭ������������Ʒ�в������������ƣ���ҺB�м���һ��������������������ɫ�����ң��Ȼ��غ��������������Ȼ���������������Ʒ�д����Ȼ��أ�������Ϊ�Ȼ������������п��ܴ�������ͭ��þ�ۡ�̼�ۣ�����������ᣬ���˵õ���ҺD�������������������ϡ���ᣬ����ͭ�����ᷴӦ�����Ȼ�ͭ��þ�����ᷴӦ�����Ȼ�þ���������Ȼ�ͭ��þ��Ӧ���ɽ���ͭ��Cu�ڿ�����������������ͭ�����ɵ��������ڿ��������գ��й��������˵��������������ͭ�ͽ���þ��̼��������Ӧ���ɶ�����̼�����й�����������ܺ���̼��������������һ�����е�����������ͭ��þ�������Ǵ���̼��
�������Ϸ�����֪��
��1�����ɰ�ɫ���������ҵķ�Ӧ���Ȼ��غ���������Ӧ�����Ȼ�������������أ���ѧ����ʽΪ��KCl+AgNO3=AgCl��+KNO3��
��2��ԭ������һ�������е��������������ƣ�ԭ���ǣ���ҺA�м������������ͭ��Һ������������
��3����������һ�����е�����������ͭ��þ��
��4����ҺC��һ������������Cu(NO3)2��KNO3�����ܴ���KCl��AgNO3�е�һ�֣���ҺD��һ������������HCl��MgCl2�����ܴ���CuCl2����ҺC����ҺD�����뵽��Һ�ף��а�ɫ�������ɣ���ɫ����ΪAgCl���ϲ���ҺE�в����������ӣ�˵��HCl��MgCl2�Ѿ���AgNO3��Ӧ��ȫ���ֱ�����HNO3��Mg��NO3��2��AgNO3�Ƿ�ʣ��δ֪�����E��һ�����е�������KNO3��HNO3��Cu��NO3��2��Mg��NO3��2��