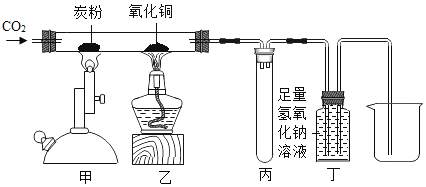
题目内容
【题目】我国属于海洋大国,浩瀚的海域蕴藏着丰富的化学资源。
(1)海底蕴藏着大量的煤、_____、天然气等化石燃料。
(2)天然气燃烧反应前后分子种类变化的微观示意图如下所示。
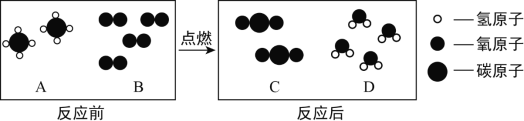
①四种物质中属于化合物的是_____(填图中字母)。
②若8g A参加反应,则生成C的质量为_____g。
(3)海水晒盐能够得到粗盐和卤水。卤水中含有MgCl2、KCl和MgSO4等物质,下图是它们的溶解度曲线。
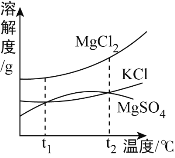
①t1℃时,MgCl2、KCl和MgSO4三种物质的饱和溶液中,溶质质量分数最大的是_____。
②将t2℃的MgCl2、KCl和MgSO4三种物质的饱和溶液加热到t2℃以上时,可能会析出_____晶体。
【答案】石油 ACD 22 MgCl2溶液 MgSO4
【解析】
(1)浩瀚的海域蕴藏着丰富的煤、石油、天然气等等常规化石燃料;
(2)①化合物是由不同种元素组成的纯净物,A的分子是由两种原子构成的,即物质是由两种元素组成的,为化合物;B分子由2个相同的原子构成,即是由同种元素组成的,为单质;C分子是由两种原子构成的,即物质是由两种元素组成的,为化合物;D分子是由两种原子构成的,即物质是由两种元素组成的,为化合物;故填:ACD;
②根据反应微观示意图知,每2个A分子与4个B分子反应,能生成2个C分子和4个D分子,可以得出甲烷燃烧的化学方程式:![]() ;故参加反应的A甲烷与C二氧化碳的质量之比为4:11,若8gA参加反应,则生成C的质量为22g;
;故参加反应的A甲烷与C二氧化碳的质量之比为4:11,若8gA参加反应,则生成C的质量为22g;
(3)①通过观察溶解度曲线,可以判断出和t1℃时氯化镁饱和溶液的溶质质量分数最大;
②溶液从t1℃升温到t2℃时,只有硫酸镁的溶液在溶解度曲线上对应的点会位于溶解度曲线以上,所以只有硫酸镁可能会析出。

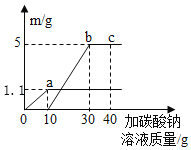
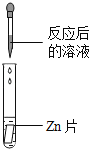
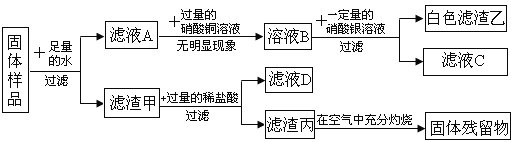
【题目】碳酸氢钠是小苏打的主要成分,在生产和生活中有许多重要的用途。化学课上,同学们为了解碳酸氢钠的性质,将一定质量的碳酸氢钠和稀硫酸混合,充分反应后,有气体逸出,写出该反应的化学方程式_____,同学们对反应后溶液中溶质的成分进行了探究:认为除一定含有硫酸钠外可能还含有其他成分,因此进行了猜想并做了如下实验:
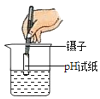
(实验用品)pH试纸、锌片、氧化铜粉末、稀硫酸、氢氧化钠溶液、氯化钡溶液。
(猜想与假设)反应后溶液中溶质的可能组成成分。
猜想一:硫酸钠
猜想二:硫酸钠、碳酸氢钠
猜想三:硫酸钠、硫酸
(实验探究)同学们取反应后的溶液用不同方案进行如下实验,请根据结论完成如表实验现象中的空格。
实验方案 | A | B | C | D |
实验操作 |
|
|
|
|
实验现象 | _____ | 产生白色沉淀 | 试纸变色,对照标准比色卡,pH<7 | _____ |
实验结论 | 猜想二不正确 | 猜想三正确 | 猜想三正确 | 猜想三正确 |
(得出结论)猜想三正确。
(评价反思)
(1)老师对同学们能用多种方案进行探究,并且得出正确的实验结论给予了肯定,同时指出探究中存在一处明显的操作错误是_____。
(2)有同学对实验方案B的结论提出了质疑,认为仅凭此现象不能得出猜想三正确,请说明理由_____。
(总结提高)依据所给实验用品,设计与上述实验不同的方案,确认猜想三是正确的,请你写出你的实验方案_____。
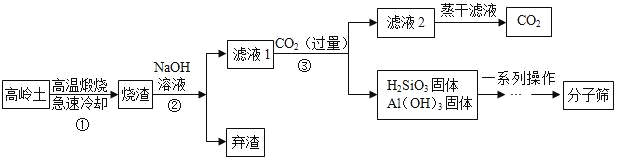
【题目】某小组在实验室中探究金属钠与二氧化碳的反应,选用如图所示装置及药品进行实验。已知:
钠 | 氧化钠 | 过氧化钠(Na2O2) |
银白色固体 | 白色固体 | 淡黄色固体 |
回答下列问题:
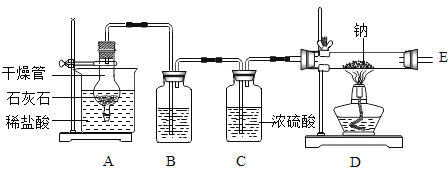
(1)打开活塞,制取CO2。为了得到干燥、纯净的CO2,B中盛有_____(填试剂名称)。反应结束后,关闭活塞,干燥管内可观察到的现象是_____ 。不能用稀硫酸代替稀盐酸,其原因是___。
(2)金属钠与二氧化碳反应的实验步骤及现象如下表:
操作步骤 | 实验现象 | |
1 | 打开活塞,待玻璃管中充满二氧化碳后,点燃酒精灯加热。 | 产生大量白烟,玻璃管壁上有黑色 固体产生。 |
2 | 冷却后,将玻璃管中的固体全部取出,并置于试管中,加入适量的蒸馏水,振荡、过滤。 | 滤纸上留下黑色物质,滤液为无色溶液。 |
①验证玻璃管中充满二氧化碳的方法是_____。
②为检验玻璃管中白色物质的成分,取适量滤液于2支试管中,向一支试管中滴加1滴酚酞溶液,溶液变红;向第二支试管中滴加氢氧化钡溶液,溶液变浑浊。据此推断,白色物质的化学式是___.(填标号)。
ANa2O BNa2O2 CNaOH DNa2CO3
③经检验,滤纸上留下的黑色固体是一种单质,请写出它能与其他黑色固体反应的化学方程式:_____________________________.(任写一个)。
④本实验中金属钠与二氧化碳反应的化学方程式为______________________。