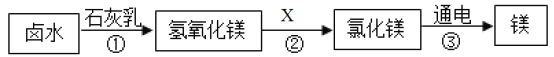
题目内容
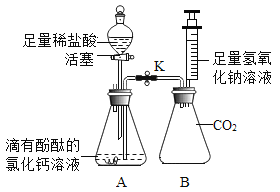
【题目】下列是与铁的性质有关的部分实验图,请回答下列问题。
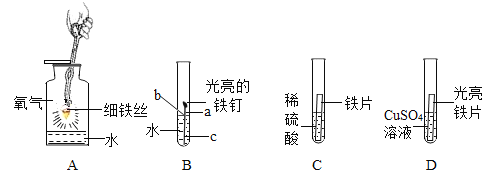
(1)A中发生化学反应生成的黑色固体的化学式为_____________。
(2)B中铁钉最易生锈的部位是_____________(填“a”、“b”或“c”)。
(3)C试管内发生的化学反应的化学方程式是_________________。
(4)D中反应一段时间后,若反应后铁片有剩余,则溶液中一定存在的金属阳离子为_________.
【答案】Fe3O4 b Fe+H2SO4=FeSO4+H2↑ Fe2+
【解析】
(1)铁丝在氧气中燃烧生成黑色四氧化三铁;故化学式为:Fe3O4;
(2)铁生锈的条件:铁与水和氧气同时接触,所以因b处与水和氧气同时充分接触,所以最易生锈;
(3)铁与硫酸反应生成硫酸亚铁和氢气;反应的化学方程式:Fe+H2SO4=FeSO4+H2↑;
(4)铁能与硫酸铜溶液发生置换反应生成铜和硫酸亚铁,因为铁有剩余,所以硫酸铜全部参加反应,此时溶液中只存在亚铁离子,符号为:Fe2+。

练习册系列答案
 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案
相关题目