题目内容
【题目】有一种石灰石样品的成分是CaCO3和SiO2。课外小组同学将88.8 g盐酸加入到35 g石灰石样品中(已知SiO2不与盐酸反应),盐酸与碳酸钙恰好完全反应,收集的气体质量为8.8g,(以下计算均需写出计算过程,假设实验过程中溶液损失忽略不计)
(1)写出盐酸与碳酸钙反应的化学方程式:_______
(2)计算35g样品中CaCO3的质量_________。(写出计算过程)
(3)反应后过滤,得到CaCl2溶液,将此溶液配成10%的CaCl2溶液,①计算:这时还需要向滤液中加入水多少克?②量取:量取一定量体积的水,倒入氯化钙溶液的烧杯中。③混匀:用玻璃棒搅拌,使___。
【答案】2HCl+CaCO3=CaCl2+H2O+CO2↑ 20g 122 ③溶液混合均匀
【解析】
根据生成的二氧化碳的质量和对应的化学方程式求算碳酸钙的质量和生成的氯化钙的质量,进而展开计算。
解:(1)碳酸钙和盐酸反应生成二氧化碳、水和氯化钙,对应的化学方程式为:2HCl+CaCO3=CaCl2+H2O+CO2↑;
(2)、 (3)设碳酸钙的质量为x,生成的氯化钙的质量为y,
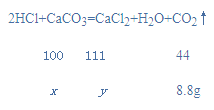
![]() x=20g,
x=20g,
![]() y=22.2g,
y=22.2g,
此溶液配成10%的CaCl2溶液的质量为![]() =222g,则加入的水的质量为222g-(20g+88.8g-8.8g)=122g,溶解过程中玻璃棒的作用是使混合均匀。
=222g,则加入的水的质量为222g-(20g+88.8g-8.8g)=122g,溶解过程中玻璃棒的作用是使混合均匀。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目